【佐賀大のバイオプリンタ製人工血管】スフェロイドの作製方法から独自技術・剣山メソッドを解説

佐賀大学の中山功一先生の研究グループが、バイオプリンタで皮膚の細胞を使って作製した人工血管を透析患者に移植する臨床研究を申請した、という報道がありました。
今回はこのニュースを深掘りします。
深掘りポイントは、
・人工透析の仕組み・シャントとは?
・人工血管作製のもとになるスフェロイドとは一体何か?
・使用されたバイオプリンタ「レジェノバ」の独自性
では、さっそくみていきましょう!
レジェノバについて詳しく知りたい方は、記事後半に加えて、こちらの記事もどうぞ。
目次
人工透析に人工血管が必要な理由
そもそも人工透析とは?
人工透析とは、衰えた腎臓の代わりとなって、身体の老廃物や毒素を排出し、血液を浄化することです。
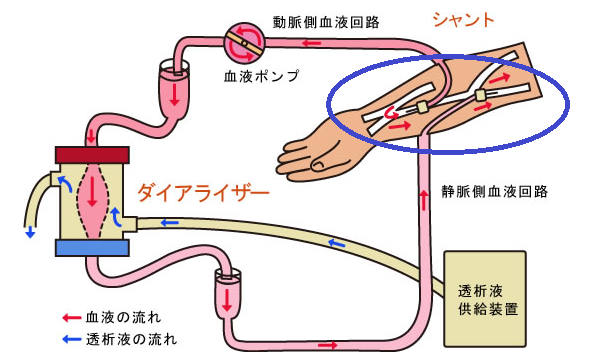
出典:奥田クリニック
上の画像の青色で囲んだ箇所を拡大したのがこちら。↓
動脈と静脈をつなげた箇所をシャントといいます。
図でわかるように、動脈の血液が静脈に流れていますね。静脈に血液が入ることで、静脈が太くなり、針を刺しやすくなります。そこで、静脈に針を刺し、ダイアライザー(人工腎臓)に流し、きれいになった血液が再び静脈に戻るようになっています。
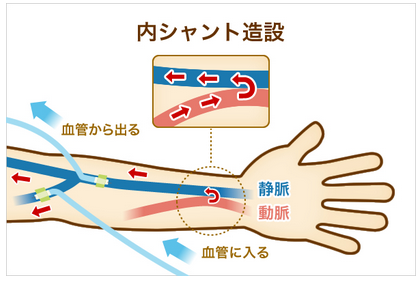
出典:池袋血管外科クリニック
シャントは自己血管で作るのが望ましいですが、糖尿病や動脈硬化など血管の状態が悪い場合、自己血管を使うことができません。その場合は、人工血管で代用します。
従来の人工血管は、テフロンやポリウレタンなどを使用したものでした。今回佐賀大学が開発したのは、細胞を使った人工血管です。
人間の細胞で作られたものですので、感染症を起こしにくく、繰り返し注射されても、自己再生できるというメリットがあります。
では、細胞からどのように人工血管を作るのでしょうか?
まず、バイオプリンティングの基礎となる、スフェロイドという概念についてみていきましょう。
スフェロイドとは?
スフェロイドとは、多数の細胞が集まった塊のことです。
これは1つの細胞から組織ができるまでを簡単なフローチャートにしたものです。青枠で囲んだのがスフェロイドです。
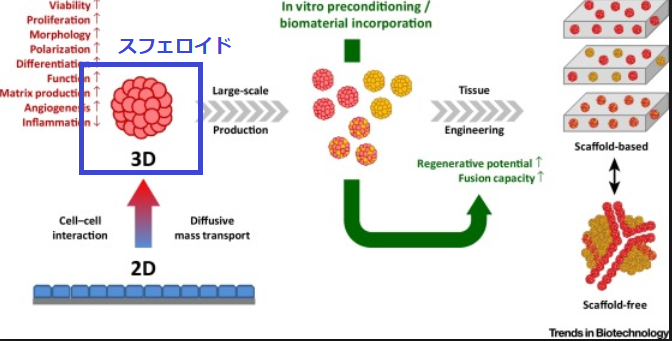
出典:Life is 3D: Boosting Spheroid Function for Tissue Engineering
図でわかるように、スフェロイドは三次元的な構造を持ちます。
これに対し、プレート基板に細胞を播種して培養する場合、細胞が形成するのは二次元的な構造であり、in vivoの細胞がもつ立体構造とは異なります。
創薬スクリーニングや安全性試験に用いるためには、生体の状況により近い三次元構造を維持した細胞群が必要です。実際に、二次元的に培養された細胞群と、三次元的に培養された細胞群では、分化能や薬剤への反応が異なることが報告されています。
そこで再生医療、創薬スクリーニングの分野では、スフェロイドという三次元的な細胞群を活用した研究が行われています。
細胞がスフェロイドを形成できるのはなぜ?
細胞がスフェロイドを形成できるのは、細胞に接着性があるためです。
細胞には、細胞と基質(細胞外マトリクス)それぞれに接着する性質があります。
基質と接着できない環境では、細胞同士が接着し、スフェロイドを形成することができます。
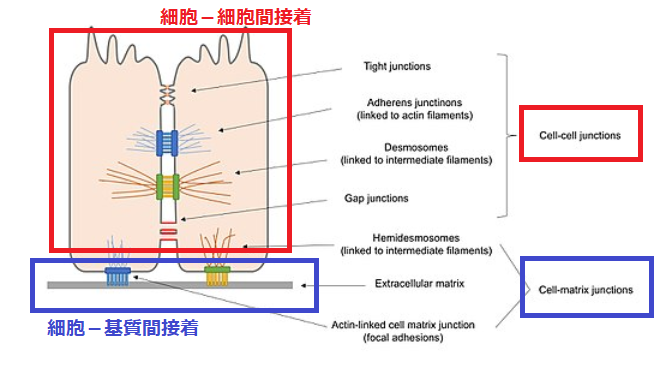
出典:wikipediaをもとに加工
スフェロイドについておおまかに理解できました。
次に、スフェロイドの作製方法についてみていきます。
スフェロイドの作製法
スフェロイドの作製法には主に次のものがあります。
・ハンギングドロップ法
・Non-adhesive surfaces法
・スピナーフラスコ(バイオリアクター)法
・マイクロモールディング法
(調べていたらどれも興味深く、実際に操作現場を見学してみたくなりました)。
ハンギングドロップ法
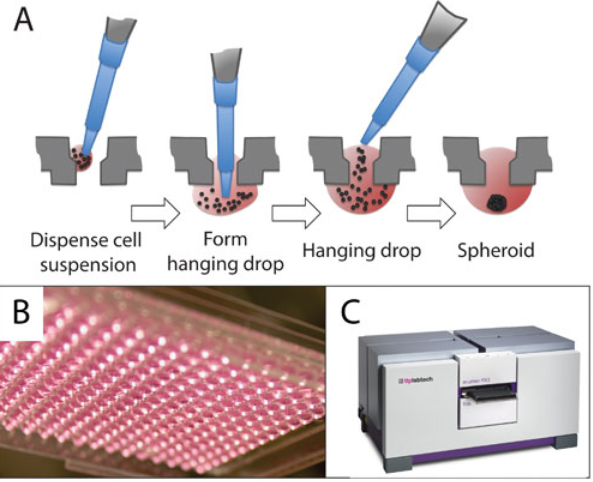
出典:genengnews.com
細胞を含んだ懸濁液を含んだマイクロピペットをディッシュにあいた穴に通し、懸濁液を押し出してドロップをつくります。マイクロピペットを抜くと、ドロップが穴の部分に留まり、細胞が重力の作用で下に凝集していきます。
ハンギングドロップ法は、細胞の重力と表面張力を利用しています。
F(上向きの力)>mg(m=質量、g=重力加速度)の時に、ドロップは落下せず、穴に留まります。懸濁液が50μLを超えると、ドロップの重力が表面張力による引っ張る力に打ち勝つため、穴にとどまらず落下してしまいます。
ハンギングドロップ法はつまり、ゆっくり待って、重力の作用で下に凝集するのを待つ方法ですね。
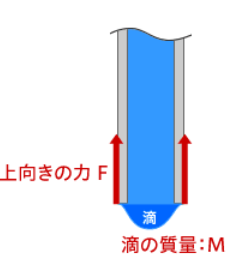
出典:mohno-dispenser.jp
この動画がとてもわかりやすいです。
メリット
細胞数が揃った均一な細胞スフェロイドになりやすい
デメリット
広いスペースが必要
作業が繁雑なため、大量作製は困難
時間がかかる
Non-adhesive surfaces法
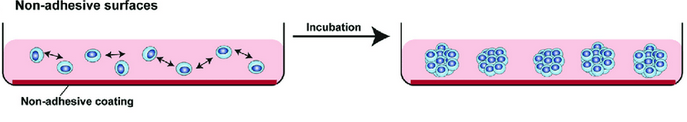
出典:Three-Dimensional Patient-Derived In Vitro Sarcoma Models: Promising Tools for Improving Clinical Tumor Management
細胞が底面に接着しないように、アガロース、poly-HEMA、ジメチルポリシロキサン、プロテオグリカンなどでコーティングした培養プレートに細胞を播種し、細胞同士を凝集させてスフェロイドを得る方法です。
プレートに播種して、自由に凝集させるやり方ですね。
メリット
一度に大量のスフェロイドが作製可能
デメリット
均一な形状や大きさのスフェロイドを作製するのが難しい
細胞の種類によって得られる平均サイズも大きく異なる
スピナーフラスコ(バイオリアクター)法

出典:www.sci-tech.co.jp
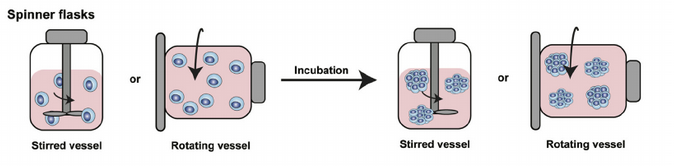
出典:Three-Dimensional Patient-Derived In Vitro Sarcoma Models: Promising Tools for Improving Clinical Tumor Management
スピナーフラスコに細胞懸濁液を入れ攪拌することで、細胞がプレート面に接着するのを防ぎ、細胞同士を凝集させスフェロイドを得る方法です。
メリット
大量培養が可能
操作が簡単
デメリット
細胞が攪拌棒によるせん断応力を受けるため、せん断応力に敏感な細胞や凝集力の低い細胞には向かない
スフェロイドのサイズを均一にコントロールしにくい
特別な装置が必要
バイオリアクターとして細胞培養チャンバーを回転させる方法もあります。この場合、チャンバー自体が回転するため、攪拌棒は必要でなく、細胞が受ける力が弱いのが特徴です。
マイクロモールディング法
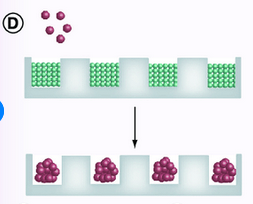
出典:3D tumor models: History, advances and future perspectives
マイクロモールディング法は、細胞が接着しない材料を使って均一なマイクロウェルを培養基板上に多数配置し、スフェロイドを得る方法です。
マイクロウェルは細胞非接着性の材料からできているため、細胞を播種しても基板に接着しません。
マイクロウェルの作製方法は次のイメージです。
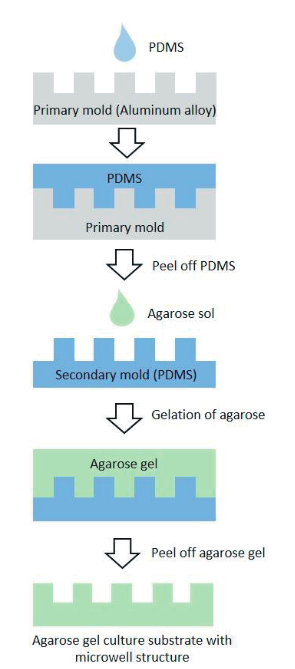
出典:スフェロイド形成基板の作製とヒト由来毛乳頭細胞の培養
一次鋳型(グレー)にポリジメチルシロキサン(PMDS)を流し込み、二次鋳型とします(水色)。
二次鋳型にアガロースゲルを流し込みゲル化させて得られたアガロースゲル基板(緑色)を、マイクロウェル基板として使います。アガロースは細胞非接着性の性質を持つので、この基板に播種された細胞は、基板には接着せず、細胞同士が凝集し、スフェロイドを形成します。
実際のマイクロウェル基板はこんなに小さいです。
出典:funakoshi.co.jp
メリット
大量作製が可能
スフェロイド1個あたりの細胞数やサイズを均一にできる
マイクロウェルの形状を変化させることで、複雑な形状のスフェロイドを作製できる
デメリット
ウェルの形状に制限を受けて、各ウェルに懸濁液を配置できるとは限らず、スフェロイド1個あたりの細胞数が不均一になることがある
独自技術を有するバイオプリンタ「レジェノバ」
では、佐賀大学で使用されたレジェノバというバイオプリンタについてみていきましょう。
これは、バイオプリンティングのベンチャー企業サイフューズと澁谷工業が開発したバイオプリンタです。
特徴は、
・スキャフォールドフリーである
・独自の剣山メソッドを使っている
スキャフォールドというのは細胞が成長するための足場のことです。
従来の再生医療では、組織作製する上で、足場となるスキャフォールドを使っていました。現在は、スキャフォールドを使わない、スキャフォールドフリーの手法が増えてきています。
このメリットは、細胞100%による組織を作製できること。人工的な材料や、動物由来の材料を使わずに、立体組織をつくれることです。
スキャフォールドフリーを実現したのが、剣山メソッドです。
中山先生は、骨折治療の過程からこの着想を得られたようです。
折れた骨をプレートやギプスで仮固定すると、骨片同士が生体の治癒力によって融合し、最終的にプレートやギプスを外せますよね。中山先生は、スフェロイド同士が近接すると融合する現象と、骨折治療に共通項を見出し、スフェロイドを融合させるうえで、骨切片の「仮止め」という手法を応用しました。
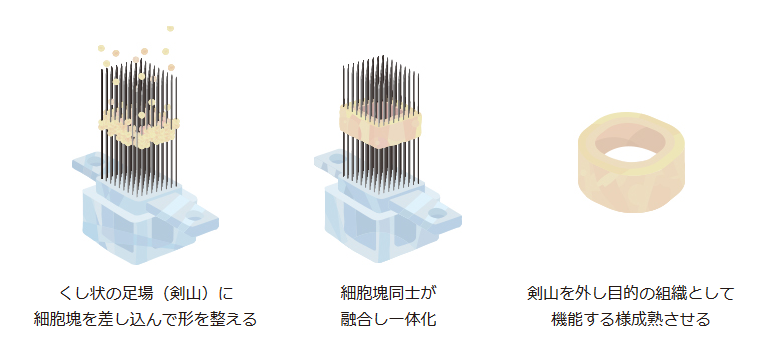
出典:サイフューズ
手順
①剣山のようなニードルアレイに装置(レジェノバ)で、スフェロイドを串刺ししていきます(スフェロイドの仮止め)。
レジェノバは1時間あたり約300個のスフェロイドを串刺しすることができます。
②串刺しにした状態で培養することで、近接したスフェロイドが融合し、立体物となります。
③ニードルアレイを取り除くと、100%細胞からできた細胞立体物を得られます。
この技術を最初に知ったときは興奮しました。
こちらは以前、再生医療展示会で見てきた実際のニードルアレイです。

ニードルアレイに串刺しして培養中の様子。

出典:Scientific Reports
今回の報道で発表された画像がこちら。
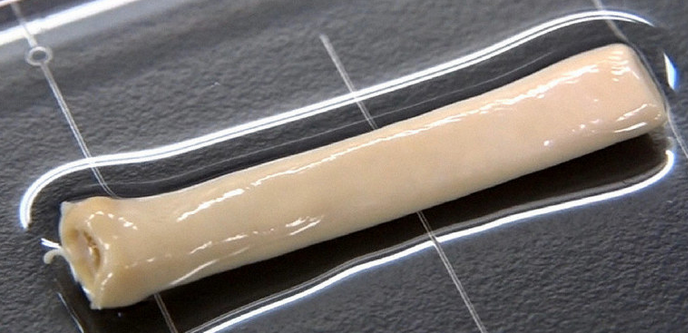
出典:毎日新聞
佐賀大学の技術によって、人工透析に限らず、成長に伴い血管の再手術をする必要がある小児患者に対し、自己細胞からできた人工血管の移植も可能になりそうですね。
今回発表された臨床研究は、AMEDに採択されたもののようです。
平成31年度 「再生医療実用化研究事業(一次公募)」の採択課題について
まとめ
3Dプリンタの影響力が、プロトタイプから完成品→家庭(趣味)→教育(STEAM)→医療・バイオへと、広がりを増していますね。
先日の記事でも取り上げましたが、サイフューズ社は世界で注目されるバイオプリンティングのベンチャー企業です。
残念なことに日本には、米国や中国に比べ、バイオプリンティングのベンチャーが少ないのが現実です。
一方で、米国では子供向けの本にもバイオプリンティングの話が登場します。中国なんて、小学校40万校に3Dプリンタを導入することを発表しています。
この差は一体どんな形となって顕在化していくのでしょうか。。。
不安を感じつつ、今後も3Dプリンタに関する情報をお伝えしていきます。何か記事のリクエストがありましたらお問合せフォームからお寄せください。
参考
3D tumor models: History, advances and future perspectives
Advances in the formation, use and understanding of multi-cellular spheroids
関連記事
サイフューズ・澁谷工業のバイオプリンタ「レジェノバ」の紹介 ー串刺ししない新たな剣山メソッドも登場ー
世界のバイオプリンティング企業14社ーバイオプリンティングの競争は続く-
バイオプリンティングの原理、各方式のメリット・デメリットを解説
バイオプリンタで患者の細胞から血管付き人工心臓の作製に成功【原理を解説】(テルアビブ大学)
【ネイチャー論文を解説】移植後に長期生存が可能な免疫不全ブタモデルの作製に成功(慶応大・佐賀大の快挙)