拡大するOrgan-on-a-chip市場、産学官連携で国際競争に挑む日本

今回は、生体反応をin vitro(生体外)で再現するOrgan-on-a-chipについて、海外の主要プレーヤーと、日本の研究動向を調べましたので、概要をお伝えします。
ハーバード大学のLung-on-a-chipから始まったOrgan-on-a-chipは、現在では、
チップ上に単一臓器を搭載したOrgan-on-a-chip、
複数の臓器を連結したOrgans-on-a-chip、Multi-organ-on-a-chip、
主要な臓器をすべて連結したHuman-on-a-chip、Body-on-a-chip
などさまざまなものが登場し、呼び方はまだ統一されていない印象を受けます。
Microphysiological System(MPS)(邦訳は生体模倣システム)という新たな呼び方も登場しています。
MPSは、チップからデザイン、培地の駆動法、分析装置などの研究も含め、より包括的な概念を示しています。
個人的にはOrgan-on-a-chipよりも生体模倣システムという方がしっくりきました。
ではさっそくみていきましょう。
拡大するOrgan-on-a-chip市場
https://www.psmarketresearch.com/market-analysis/organ-on-chip-market
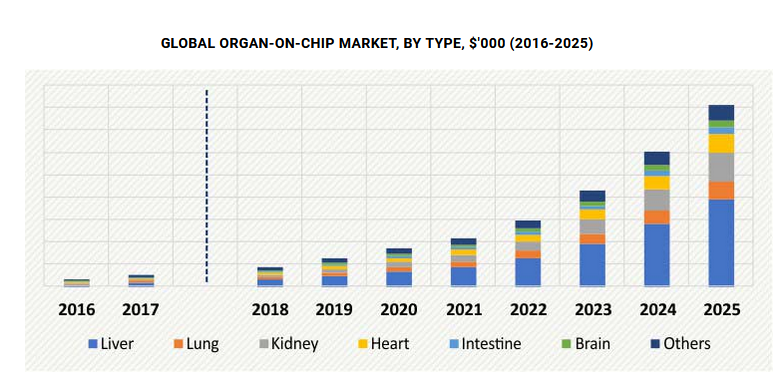
2018年3月のレポートによると、Organ-on-a-chipの市場は上記の通り、今後大きな拡大が予想されます。
上記グラフは、Organ-on-a-chipの臓器別の市場規模を示したもので、肝臓の全体に占める割合が大きいことがわかります。
このレポートによると、2017年ではOrgan-on-a-chipの研究開発は北米で盛んに行われていますが、その背景には、政府や主要企業からのバックアップがあるようです。
軍事利用から創薬応用へ
Organ-on-a-chipの中でも、チップ上に複数の臓器を連結したMulti-organ-on-a-chipが世界から注目されたのは、2012年でした。
DARPA(アメリカ国防高等研究計画局)がNIH(アメリカ国立衛生研究所)とともにMulti-organ-on-a-chipを開発するために、3,700万ドルのプロジェクトをスタートさせたのです。
資金提供しているのがDARPAであることからも、これは軍事利用のための技術開発でした。
その後、NIH傘下のNCATS(National Center for Advancing Translational Sciences)がFDAと提携し、「Tissue Chip for Drug Screening」を推進し、研究の軸が創薬応用など実用化に軌道修正されたとのこと。
やっぱりといいますか、怖い話ですよね。
免疫学の発展を後押ししたのは、戦場で感染によって死ぬ兵士が多かったと言われていますが、生体模倣システムの原動力も軍事目的だったというのは、技術開発の進展を手放しで喜べず複雑な気持ちになります。
話がそれましたが、次に、製品化している企業を一部ご紹介します。
Organ-on-a-chipを製品化している企業のほとんどがベンチャー企業です。
Organ-on-a-chipを製品化している世界の主な企業
企業名とURLだけ掲載しています。興味のない方はとばしてください。
Micronit(オランダ)
Kirkstall(米国)
ピサ大学のスピンアウトベンチャー
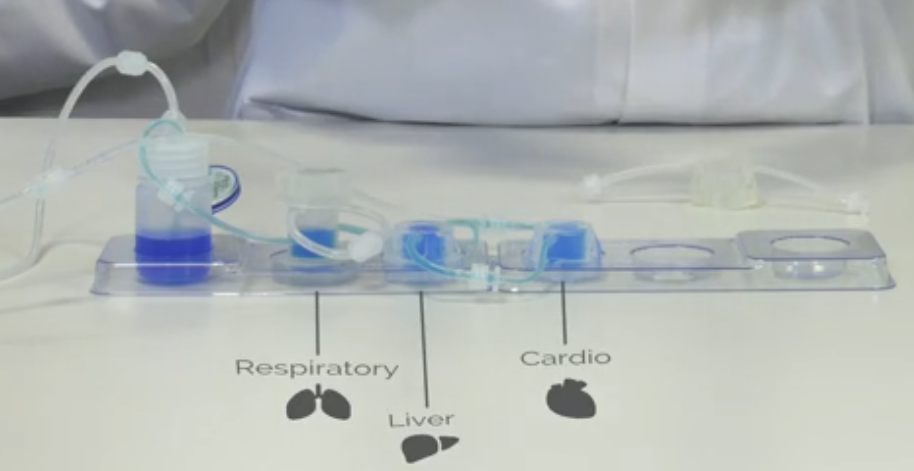
KirkstallのQuasi Vivo®
Hesperos
複数組織の培養システムの創始者である米国コーネル大学のM.L. Shulerによるスピンアウトベンチャーです。
Nortis(米国)
ワシントン大学のスピンアウトベンチャーです。
Mimetas(オランダ)
Emulate(米国)
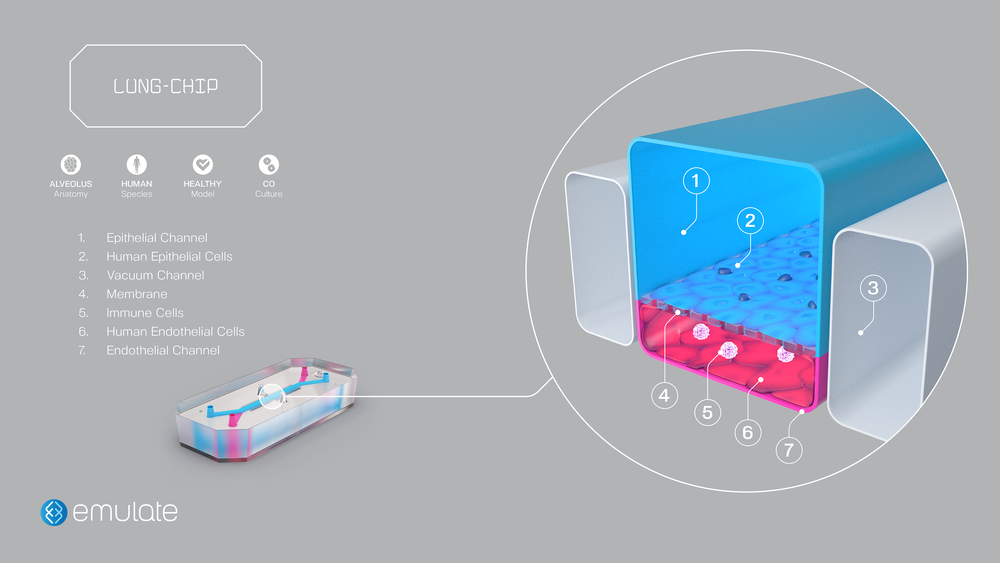
https://www.emulatebio.com/lung-chip
Wyss instituteのドナルド・E・イングバーによるスピンアウトベンチャーです。
cNBio Innovations(英国)
TissUse(ドイツ)
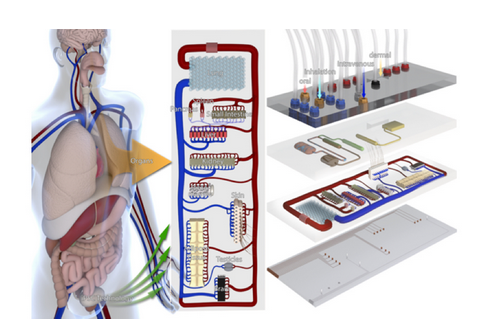
https://www.tissuse.com/en/technology/
https://www.tissuse.com/en/technology/
産学官連携で国際競争に挑む日本
このように、海外では大学のスピンアウトベンチャーによる開発が盛んであり、日本はやや遅れている印象があります。
Organ-on-a-chipは2016年の世界経済フォーラムで「the top 10 emerging technologies pf 2016」に選ばれており、今後も国際競争は激しくなっていくと思われます。
そこで、国際競争に挑むためにAMEDが発足したのが、「再生医療技術を応用した創薬支援基板技術の開発」プロジェクトです。
官庁、大学、企業が参画するプロジェクトで、参加されている先生方と研究内容をまとめたのが次のマインドマップです(敬称略)。

これではわかりづらいので、概要をまとめると、次の流れでヒトでの薬物動態から安全性等を予測できるOrgan(s)-on-a-chip/Multi-organ-on-a-chipの構築を目指しています。
①デバイスと、デバイスに搭載するための細胞を開発し、これまでにない培養モデルを構築(項目2-1、2-2)
②産業化を可能にするデバイスの製造技術を開発(項目1)
③デバイスを用いて細胞培養する上での基準を作成(項目3)
④iPS細胞由来の肝細胞と同一ドナーの肝細胞について、機能の相関性を明らかにする(項目4)

国立医療研究開発機構
①の培養モデルの研究内容を分類すると、次の3つに分けられます。
●腸肝循環
●血液脳関門
●腎臓
上記3つの中で、(私が)特に興味があるのが血液脳関門(BBB)デバイスの開発です。
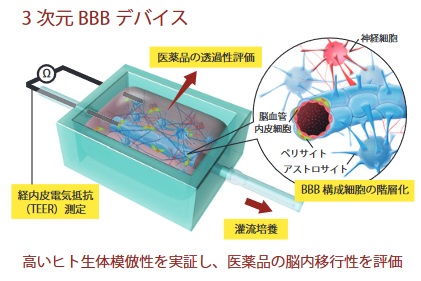
https://www.amed.go.jp/content/000029704.pdf
血液脳関門とは、血液から脳組織への物質の移行を制限する仕組みのことです。
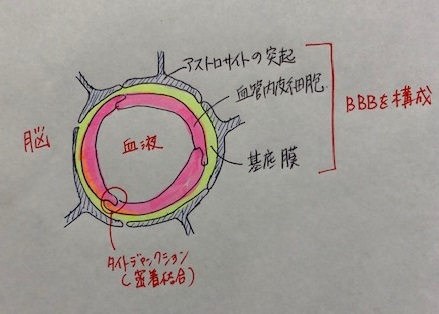
脳・脊髄の毛細血管にはタイトジャンクション(密着結合)という強力なバリアがあるため、物質の侵入を防いでいます。
といってもすべての物質が制限されるわけではなく、物質によって次のように違いがあります。
酸素や二酸化炭素などの気体➡自由に行き来できる
グルコース、アミノ酸➡選択的に輸送される
薬剤など➡輸送されない
そのため、血液脳関門は中枢神経系の医薬品開発の障壁となっています。
AMED事業では、血液脳関門デバイスの開発プロジェクトが2つ進行(竹内先生と松崎先生)しています。
このことからも、AMED事業が、中枢神経系の医薬品開発に求められてきた血液脳関門の模倣システムの構築という、より実用的な創薬応用にテーマがしぼられていることがわかりますね。
もう1つ、腸肝循環について簡単に触れておきます。
腸肝循環とは、肝臓で胆汁中に排泄された薬剤が腸管に行き、腸間で再吸収されて門脈を経由して再び肝臓に戻ることをいいます。
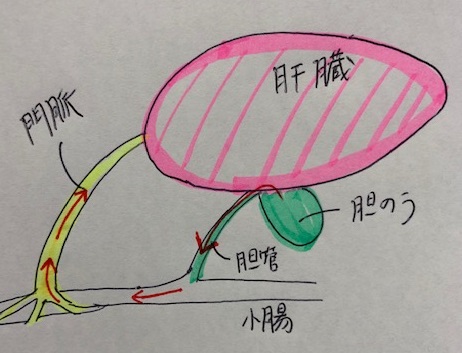
腸肝循環現象の評価は、薬物動態を予測する上で大変重要なのですが、評価できる手法は現在はありません。
酒井先生や鳥澤先生は、腸肝循環の薬物動態を再現できるデバイスが研究しています。
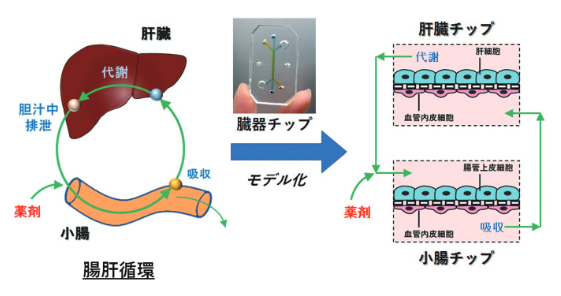
https://www.amed.go.jp/content/000029704.pdf
AMED事業の研究は、2020年まで続き、最終報告は2021年の予定です。
2019年に中間報告が予定されていて、おそらく、学会や展示会でも成果報告がされていくだろうと思います。
2020年の再生医療学会でも報告があるはずですので、引き続き注目していきます。
海外企業の技術についても、少しずつ調べていきたいと思います。
※アイキャッチ画像の出典:http://www.medicaldevice-developments.com
【参考】
2019年度再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(AMED)
Wet in-vivoシミュレーターとしてのmulti-organ-on-a-chip(MOC)への期待
Microphysiological System(生体模倣システム)の開発