注目される創薬ツールOrgan-on-a-chipに迫る!

大学時代、動物実験をせずに実習できたらどんなにいいだろうと思っていました。
卒業後は抗がん剤開発に関わっていました。
この2つに共通することは、新薬開発。新しい医薬品が上市されるまで、長い年月を要します。その要因の1つが動物実験です。
動物とヒトでは種差があるため、異なる薬剤反応を示すことがあるのです。
現在は、動物実験に替わるものとして、有効なツールがあります。
それはOrgan-on-a-chip。近年、大きな注目を集めている技術で、世界各地で活発に研究が行われています。
調べれば調べるほど、興奮する技術でした。しかも、新薬開発に限らず、化粧品・食品業界でも応用可能な技術です。一体どんな技術でしょうか?
今回はOrgan-on-a-chipをご紹介します。
Organ-on-a-chipが実現するもの
Organ-on-a-chipの何がすごいのか?を一言でいうと、
創薬における時間・コストを削減する可能性を秘めていることです。
新しい医薬品開発には、大きく2つのステップがあります。
非臨床試験(=動物を用いて薬効・薬理、毒性、安全性を確認する)
臨床試験(=健常者、患者を対象に有効性、安全性を確認する)
新薬の開発には、莫大な費用と、9~17年という長い歳月を要します。
その一因が、非臨床試験(前臨床試験ともいいます)にあると言われています。
非臨床試験で使う実験動物は、当然のことながらヒトと異なります。実験動物は主にマウスを用いて行われ、薬剤の働きがヒトと異なる可能性が高いです。
動物実験に替わるものとして、ヒト由来細胞を使ったIn vitro試験があります。いわゆる、平面培養です。しかし、In vitro試験で使われる培養プレートやウェルプレートは静置培養系で、細胞への物質供給を拡散にのみ依存しています。
このような条件下では、細胞の活性や機能は、生体内の状態よりも低下・喪失してしまいます。
また、単一細胞レベルの単純現象のみしか解析できず、組織間・臓器間の相互作用を評価することはできません。

ヒトと実験動物の種差、静置培養系の限界が原因となり、臨床試験に進んだ新薬化合物がドロップアウトしてしまうなど、非臨床試験と臨床試験とのギャップが医薬品開発においては大きな問題となっています。
もし、ヒトを対象とする臨床試験に先立ち、動物実験・静置培養系よりも、よりヒトに近い実験条件で毒性、薬効・薬理、安全性を評価することが可能になったらどうでしょう?
新薬開発に要する時間、費用が削減することになりますよね。
それを現実にする可能性を秘めたのがOrgan-on-a-chipなのです。
Organ-on-a-chipは、
In vitro(生体外)でヒトの生体応答に近い状態を再現する実験技術なのです。
微細加工技術を駆使したOrgan-on-a-chip
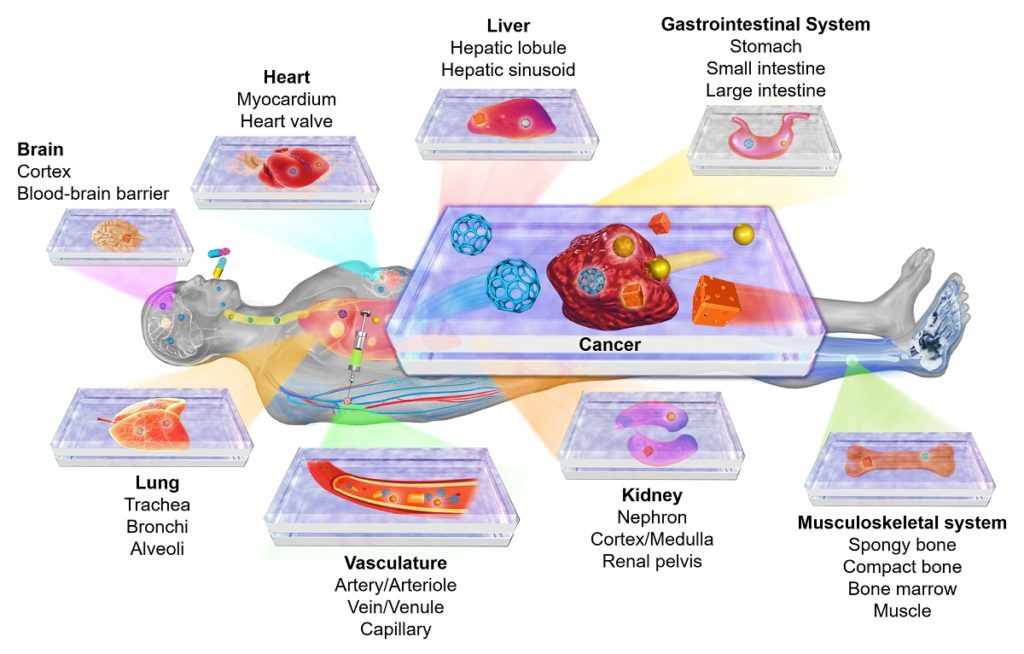
出典:Personalizing Medicine with the Organ-on-a-Chip Technology: Where Do We Stand?
Organ-on-a-chipの特筆すべき点は、
生体内の臓器の機能や構造を、USBメモリサイズのデバイス上で再現できることです。
これまでの平面培養条件では実現できなかった、
血液循環
化学的な刺激
物理的な刺激
などの動的な環境をつくることが可能となりました。
マイクロ流体デバイスを利用することで、
マイクロ流路を血管構造と見立てたり、
血管内皮細胞を培養液の流れに曝露してせん断応力に対する応用を観察したり、
近年では、
中心静脈から放射状に配列する肝細胞索構造を再現した生体チップも開発されています。
臓器の機能や構造を再現するOrgan-on-a-chipからさらに発展して、Body-on-a-chipという複数の臓器や組織の機能を再現するデバイスの開発が進んでいます。
これが非常に興味深いものでしたので、次にご紹介します。
抗がん剤の副作用を生体外で再現するBody-on-a-chip
京都大の亀井先生方の開発されたBody-on-a-chipは、1つのデバイスに正常細胞とがん細胞を搭載し、薬剤を投与したときの反応を評価するものです。

出典:抗がん剤の副作用を生体外で再現するデバイス「ボディ・オン・チップ」の開発に成功
ボディ・オン・チップのすごいところは、抗がん剤の副作用を生体外で再現していることです。
亀井先生方は、抗がん剤の副作用が発生する流れについて、次の仮説を立てました。
①抗がん剤ががん細胞を攻撃し、抗がん剤が代謝される。
②抗がん剤の代謝産物が循環器を通って心筋組織に到達する。
③代謝産物が心筋細胞へ損傷を与える。
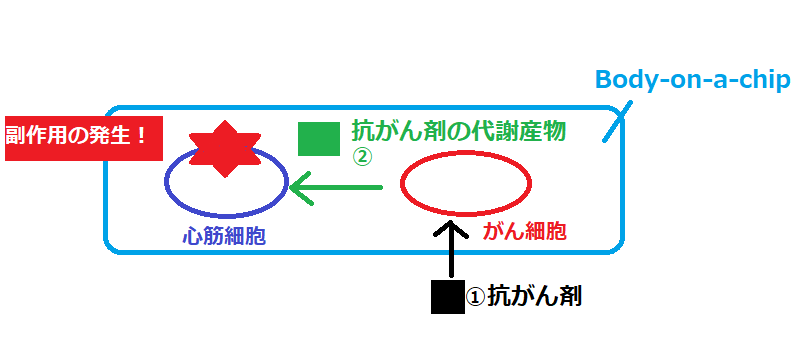
ボディ・オン・チップのイメージ
この仮説のもとに、1つのデバイスにがん細胞と正常な心筋細胞を搭載し、抗がん剤としてドキソルビシンを使用しました。
対照試験として、96ウェルプレートを使って正常な心筋細胞へのドキソルビシンを投与しました。
96ウェルプレートでは、個別に細胞を培養するため、抗がん剤を投与した後に産出される代謝産物による相互作用を評価することはできません。

出典:抗がん剤の副作用を生体外で再現するデバイス「ボディ・オン・チップ」の開発に成功を改変
結果、
96ウェルプレートでは、がん細胞の死滅は確認されましたが、正常な心筋細胞への毒性は認めませんでした。
一方、ボディ・オン・チップでは、がん細胞の死滅とともに、正常な心筋細胞への毒性も認めました。
つまり、ボディ・オン・チップ上で、ドキソルビシンによる代謝産物が、マイクロポンプによる循環灌流によって心筋細胞に到達し、毒性が発現したと考えられました。
そこで、ドキソルビシンの代謝産物ドキソルビシノールが心筋細胞にのみ毒性を示すのか確認する実験を行ったところ、ドキソルビシン(抗がん剤)は心筋細胞に毒性を示しませんでしたが、代謝産物ドキソルビシノールは心筋細胞に毒性を示すことが確認されました。
出典:抗がん剤の副作用を生体外で再現するデバイス「ボディ・オン・チップ」の開発に成功を改変
つまり、ボディ・オン・チップは、生体内でしか確認できなかった抗がん剤による副作用を、生体外で再現できることを示したのです。
動物実験とヒトでは種差がありますし、平面培養では組織・臓器間の相互作用を評価できません。
ボディ・オン・チップを使うことで、生体外で薬剤の代謝産物による副作用・相互作用を評価できることがわかりました。
薬剤の開発にとどまらず、化学物質を扱う化粧品などの分野でも、有害性・毒性試験への応用が期待されます。すごい技術ですよね?
血管新生のメカニズムを分子レベルで解明する血管チップ
2019年に発表された事例として、血管チップをご紹介します。
網膜症・がんなど血管新生が活発な組織で発現が上昇する血管内皮分泌因子にEGFL7がありますが、これまでその機能は十分に解明されていませんでした。
東京大学の松永先生方は、EGFL7の機能を解明するため、手のひらサイズの血管チップを作製しています。
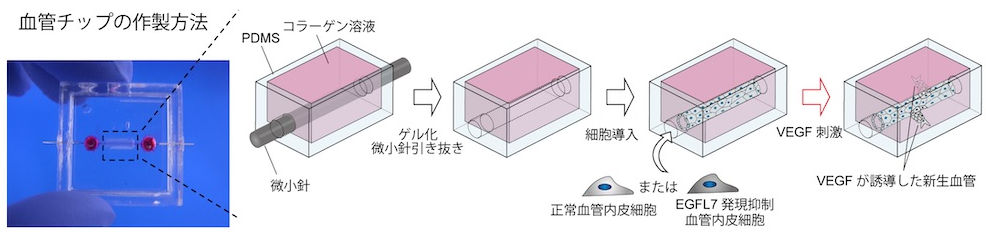
出典:東京大学生産技術研究所
ポリジメチルシロキサン(PDMS)で作製した微小チップに、微小なニードルを通してコラーゲンゲルを注入した後、ニードルを抜いて、コラーゲンゲル内に内腔を形成しました。
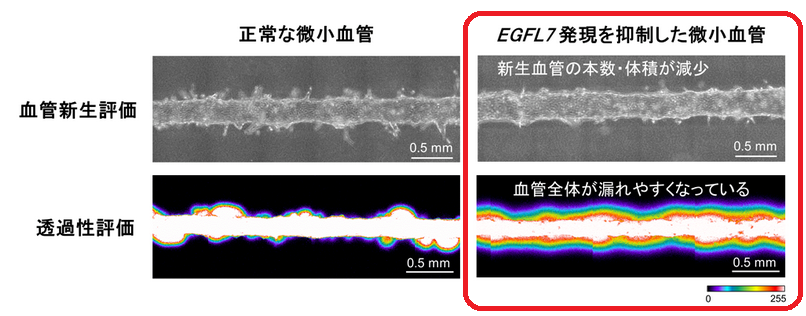
ここにEGFL7発現を低下させた血管内皮細胞を導入し、EGFL7発現が低下した血管モデルを作製しました。この血管モデルにVGFL(血管内皮増殖因子)を添加して血管新生を誘導したところ、EGFL7発現が低下した血管モデルでは血管新生が有意に抑制されました。
また、EGFL7発現が低下した血管モデルでは、血管全体が漏れやすくなっていることに着目。血管が漏れやすいということは、結合が緩み、血管のバリア機能が低下していることになります。
血管内皮細胞はオクルディンやクローディンを介した密着結合と、カドヘリンを介した接着帯(接着結合)を形成することで、血管をバリアしています。
調べてみると、EGFL7発現が低下した血管モデルでは、正常な血管と比べ、細胞間の結合が弱まっていました。EGFL7のカドヘリンに対する作用を調べてみると、EGFL7がカドヘリンの機能調節に必要なリン酸化を制御していることがわかりました。
つまり、血管チップを用いることで、EGFL7に次の機能があることがわかりました。
・血管新生に必要である(👈EGFL7低下で新生血管が減少)
・内皮細胞同士の結合を強める(👈EGFL7低下で血管が漏れやすくなる)
出典:東京大学生産技術研究所
血管チップによって、血管内皮機能を評価できるだけでなく、疾患メカニズムが解明されることも期待されています。
このほか、一部狭窄した血管モデルを作製して、生体の血栓形成に近い構造を再現することも可能となっています。
まとめ
臓器間・組織間の相互作用、薬剤の代謝産物による他の臓器への影響を、生体外で再現できるOrgan-on-a-chip。生体内で起きている現象を、生体外で再現できるツールで、調べながら興奮の連続でした。
このMEMS技術を応用した新たな創薬ツールは、2016年の世界ダボス会議で自動運転、次世代バッテリーとともに、Top 10 Emerging Technology 2016に選ばれています。
新薬開発のコストダウン・効率アップにつながるため、今後ますます注目されていくでしょう。創薬以外の分野では、動物実験の縮小化が進む化粧品や食品業界でも、今後応用が期待されます。
今回は概要と一部の研究事例の紹介だけでしたが、今後も最新の研究動向やOrgan-on-a-chip実用化に向けた課題などをご紹介していきます。
Organ-on-a-chipにすっかり魅了されてしまいました。光造形で3Dプリントできるでしょうか?
【参考】
抗がん剤の副作用を生体外で再現するデバイス 「ボディ・オン・チップ」の開発に成功
1)Organ-on-a-Chip:マイクロ流体アプローチが拓く新展開
【記者発表】血管内皮の機能を総合的に評価できる「血管チップ」を開発 ~分泌因子EGFL7の機能解析に成功
創薬を加速化するツールとしてのOrgan-on-a-chipの進展
三次元人工微小血管モデルによる血管内皮細胞のフェノタイプ解析
※アイキャッチ画像の出典:http://www.medicaldevice-developments.com
こちらの記事もおすすめ