mRNA医薬という新しい治療戦略-実用化の鍵を握るDDSキャリアとは?
7月に開催される再生医療展で、有料セミナーに当選しました!とのご連絡をいただきました。
そこで選んだのが、「mRNA医薬が生み出す新しい治療戦略」というセミナー。
今回初めて知る治療方法でしたが、調べれば調べるほど、実用化に期待が膨らむものでした。
mRNAとは、mRNAを体内に直接投与して、mRNAによってコードされたタンパク質を標的細胞で発現させることで治療する医薬品です。
mRNA医薬はDNAの段階を経ずにタンパク質を迅速に合成でき、ホストゲノムを傷つけることがありません。
細胞に入れるだけで望みのタンパク質を発現できますが、実用化に近づくまでには2つの課題がありました。
今回は、mRNA医薬と、mRNA実用化に向けて2つの課題を見事にクリアしたDDSキャリアについてご紹介します。
目次
mRNA医薬とは
メッセンジャーRNA(mRNA)を医薬品として直接体内に投与する技術は、
核酸医薬品と遺伝子治療薬の両方の性質を備えたものです。
三者の定義は次の通りです。
核酸医薬とは、十数個~数十個の核酸(DNA, RNA)で構成され、遺伝子発現を介さず、直接生体に作用するもの。
遺伝子治療薬とは、数千個以上の天然核酸で構成され、遺伝子発現を介して作用するもの。
mRNA医薬とは、酵素を使って人工合成され、遺伝子発現を介して作用するもの。
人工的に合成したmRNAを医薬品として使うメリットには以下のものがあります。
・mRNAは細胞質に入るだけでタンパク発現する
・mRNAはホストゲノムへ挿入されるリスクが無く安全である
・遺伝子配列に基づいて設計するので、低分子薬や抗体薬よりも圧倒的に速く候補化合物を取得できる
しかし、長い間、臨床応用されてこなかった背景には2つの課題がありました。
臨床応用における2つの課題
・生体内、特に細胞外では非常に不安定である
・生体内で強い炎症反応を起こす
しかし、mRNAは細胞内に常に必ず存在する物質ですよね。炎症反応が起こるのはなぜなのでしょうか?
mRNA医薬の研究者である位髙啓史先生は、
生体は自己mRNAと外来mRNAを明確に区別しているわけではなく、本来いるべきでないところにmRNAが存在した場合、集中的に攻撃される仕組みだと考えています。
ということは、DDS技術によって、本来いるべき場所にのみmRNAを届けてあげれば、免疫毒性の問題はクリアできるわけです。
同時に、
DDS技術によって細胞内に的確に届けてあげれば、mRNAは細胞内で不安定になることなく力を発揮できるというわけですね。
つまり、mRNA医薬の実用化には、DDSが不可欠ということです。
ナノDDSを実現する新規ポリマー
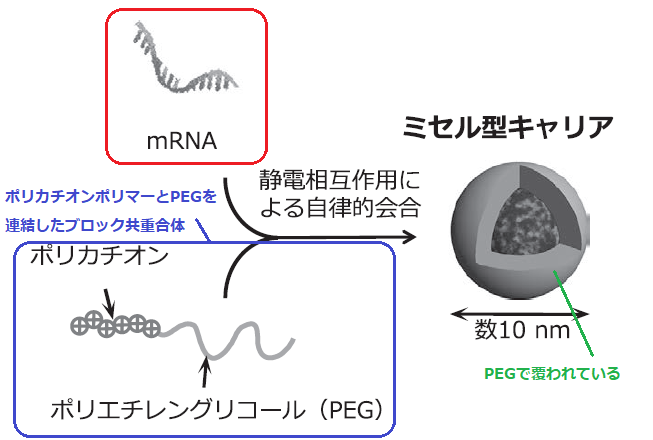
位髙先生方がこれまで研究してきたキャリアは、
ポリカチオンポリマーとポリエチレングリコール(PEG)を連結したブロック共重合体と、mRNAを混合したものです。
混合すると、内部にmRNAが凝縮され、周囲はPEGで覆われます。
出典:メッセンジャーRNA医薬の開発戦略を改変
PEGは無毒で、非免疫原性かつ親水性で生体適合性の高い物質のため、周囲をPEGで覆うことで、mRNAによる炎症反応を抑えることができます。

上のように、mRNAとポリマーが凝縮され、それをPEGが包んでいるイメージです。
位髙先生らは、キャリアに内包されるポリマーの分子デザインに工夫を重ね、高い遺伝子導入効率と低毒性を両立したmRNA医薬を開発しています。
以下、キャリアに内包されるポリマーに注目します。
新規ポリマーP[Asp(DET)]の何がすごい?
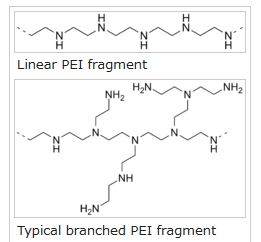
これまで遺伝子導入に使用されてきたポリマーの中で、最も高い効率を有するのはポリエチレンイミン(PEI)です。
出典:ウィキペディア
(ポリエチレンイミンには直鎖状と分岐状のものがある)
細胞培養において細胞の培養皿への定着を促進させる促進剤としても使われています。
しかしPEIには、細胞膜を破壊したり、ミトコンドリア膜を破壊したりなど、細胞毒性があるため、mRNA医薬のキャリアとしてふさわしくありません。
そこで開発されたのが、ポリアスパラギン酸を主鎖とし、側鎖にジエチレントリアミン(DET)が連結されたポリアスパルタミド誘導体(P[Asp(DET)])でした。
出典:メッセンジャーRNA医薬を実現するDDS開発と疾患治療への応用
【参考】アスパラギン酸➡ポリアスパラギン酸
出典:ポリアスパラギン酸をベースとした吸水性ポリマー
このポリマーには次の特徴があります。
・細胞膜に対する障害が小さい
・細胞内に取り込まれた後にエンドソームから細胞質への移行が促進される
細胞膜を傷つけず、かつ、細胞内に取り込まれた後は細胞質に移行されやすい、まさにmRNAが医薬品として活躍するのに適した性質を有していますよね。
なぜこれが可能になるかと言うと、pH環境に応じてポリマーのプロトン状態が劇的に変化するからです。

出典:メッセンジャーRNA医薬の開発戦略を改変
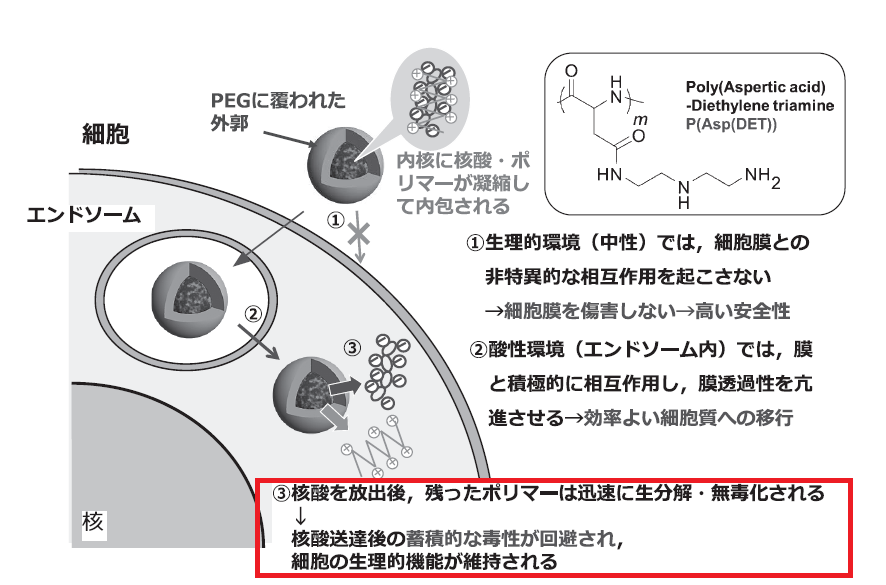
細胞外の環境(pH=7.4)では、ポリマーがモノプロトン化し、
細胞内に取り込まれた後、エンドソーム内(pH=5.5)では、エンドソームの酸性環境に応じてポリマーがダブルプロトン化します。
モノプロトン状態ではポリマーと細胞膜の相互作用が弱いため、細胞膜に対する障害が抑制されます。
ダブルプロトン状態ではポリマーとエンドソーム膜との相互作用が強くなり、エンドソームから細胞質へ【ポリマー+mRNA】の移行が促進されます。
エンドソームから移行すると、今後は再びモノプロトン状態になり、毒性が低下します。
しかし、細胞質に移行して、ポリマーとmRNAが放出されたとき、mRNAは無事届けられましたが、ポリマーが分解されずに蓄積してしまうと、結局毒性を持つことになりますよね。
どうしているのでしょうか?
mRNA送達後に急速に分解するP[Asp(DET)]
P[Asp(DET)]は37度で急速に自己分解する性質を持つため、mRNAを送達した後、細胞内で短時間でモノマーの状態に戻ります。
P[Asp(DET)]のスゴイところは、モノマーの分解産物が局所に高濃度に存在しても、ほとんど毒性を示さないことです。
一方で、従来使われていたPEIは、生体内でほとんど分解されないため、目的分子を送達できたとしても、その後数日かけて遅発性の毒性が報告されるようです。
出典;出典:メッセンジャーRNA医薬の開発戦略を改変
つまり、
お役目を果たしたポリマーP[Asp(DET)]は、mRNAを手放した後、モノマーの状態に戻り、生体内で迅速に分解されるわけですね。
このキャリアには、もう1つ面白い特性があります。
タンパク質発現のタイミング・持続性をコントロールできる
P[Asp(DET)]の側鎖には、エチレン鎖を挟んでアミノ基が2つありましたね。

出典:メッセンジャーRNA医薬の開発戦略を改変
このアミノ基の繰り返し数を変化させることで、次の違いが生まれます。
・エンドソームから細胞質への移行速度
・タンパク質の発現機能
アミノ基の繰り返し数による機能の違い

出典:メッセンジャーRNA医薬を実現するDDS開発と疾患治療への応用を改変
アミノ基の繰り返し数が偶数(n=2、4)の場合、pHに応じたモノプロトン→ダブルプロトンへの構造変化がより明瞭で、効率よくエンドソームから移行されます。
反対に、奇数の場合は、エンドソームからの移行効率は低いという結果が出ています。
プラスミドDNA(pDNA)、mRNAをそれぞれ送達したところ、偶数グループで優位に高い遺伝子発現が認められました。
しかしmRNAでは、投与直後と1日経過した時点では、タンパク質発現に違いがみられています。
投与直後では、pDNAもmRNAも偶数グループの方がタンパク質発現は高かったのに対し、
1日超えると、mRNAの場合、アミノ基の繰り返し数3のポリマーで発現が持続的に増加し、最終的に偶数グループを逆転しました。
この結果から、mRNAを送達する場合、
アミノ基の繰り返し数を偶数、奇数と変えることで、
早くタンパク質を発現させたり、持続的に発現させたりと、発現パターンを選択したり、制御したりできるようです。
面白いですよね!
疾患モデル動物における効果
これまでの研究で、以下の疾患モデル動物で、mRNAによる治療効果が確認されています。
嗅覚神経障害
椎間板疾患
嗅覚神経障害疾患モデルの事例
嗅覚神経障害の疾患モデル動物に対し、
神経の保護・再生をする神経栄養因子遺伝子をコードするmRNAを上記キャリアを用いて投与したところ、嗅覚神経の再生を認めました。
キャリアを用いないmRNA投与群では、鼻粘膜に強い炎症反応を起こすのみで、遺伝子発現は認められませんでした。
椎間板疾患モデルの事例
出典:「メッセンジャーRNA(mRNA)医薬を用いた椎間板疾患治療」
椎間板疾患モデルラットに、軟骨形成に関与する転写因子をコードするmRNAをキャリアを用いて投与したところ、投与後2週後、4週後、ほぼ正常に近い所見を認めました。
非投与群では椎間板高が著しく減少しており、キャリアを用いないmRNA投与群では、椎間板組織に強い炎症反応を認めています。

出典:「メッセンジャーRNA(mRNA)医薬を用いた椎間板疾患治療」
これらの結果から、mRNAによる炎症反応を回避するために、キャリアを使うことが有効であることがわかりますね。
椎間板疾患はQOLを著しく低下させるものですが、罹患率は80%と言われ、自然回復はおろか、根治療法は開発されていません。
加齢とともに変性が進む疾患で、高齢者にとって喫緊の問題の1つです。
mRNAキャリアを使ってmRNAを送達すれば、ゲノムを傷つけず、安全かつ効率的に治療ができそうですね。
まとめ
今回はmRNA医薬の開発状況と、臨床応用の橋渡しとなるDDSキャリアについてご紹介しました。
キャリアに内包するポリマーのプロトン状態によって遺伝子導入効率や毒性を調整したり、構造を変えることでタンパク質の発現効率や発現の持続時間をコントロールできる点が興味深いです。
今回参考にした資料の多くは2016年のものでした。再生医療展のセミナーでは、位髙先生から最新動向をお聞きできると思いますので、またご報告します。
セミナー聴講後の記事:
【参考】
メッセンジャーRNA医薬を実現するDDS開発と疾患治療への応用
新しい遺伝子治療:メッセンジャーRNA(mRNA)投与による神経障害の治療
「メッセンジャーRNA(mRNA)医薬を用いた椎間板疾患治療」
※アイキャッチ画像の出典:東京医科歯科大学
こちらの記事もおすすめ
【世界初】mRNA医薬により脊髄損傷マウスの運動機能が回復【神経再生医療に光】