【2019】iPS細胞研究アップデート・セミナーの報告【CRISPR-Cas9による拒絶されにくいiPS細胞の作製】

バイオジャパン2019で山中先生によるセミナー「iPS細胞研究アップデート」を聴講してきました。
主な内容は、京都大学のiPS細胞研究所が進めているiPS細胞のストックプロジェクトについてでした。
iPS細胞のストックプロジェクトとは、iPS細胞を必要なときにすぐに移植できるように、iPS細胞を保存しておくプロジェクトです。
現在は、HLAホモ接合体という非常にまれなタイプの細胞からiPS細胞を作製しています。ただ、このやり方では、日本人の9割をカバーするには多くの時間と費用が必要になります。
今回のセミナーのポイントは、
ドナーが非常に限られるため、人口全体をカバーするだけのiPS細胞の作製が難しいという壁を、ゲノム編集技術CRISPR-Cas9を使って解決した
というものです。
他家由来の細胞の遺伝子を、ゲノム編集ツールで一部壊し、移植したときに拒絶反応を起こしにくいiPS細胞を作れるようになりました。
現時点では、マウス体内での生存率が確認されています。
論文アブストラクトはこちらで確認できます。
Targeted Disruption of HLA Genes via CRISPR-Cas9 Generates iPSCs with Enhanced Immune Compatibility.
【2019】iPS細胞研究アップデート・セミナーの報告
まず、本記事で頻出する
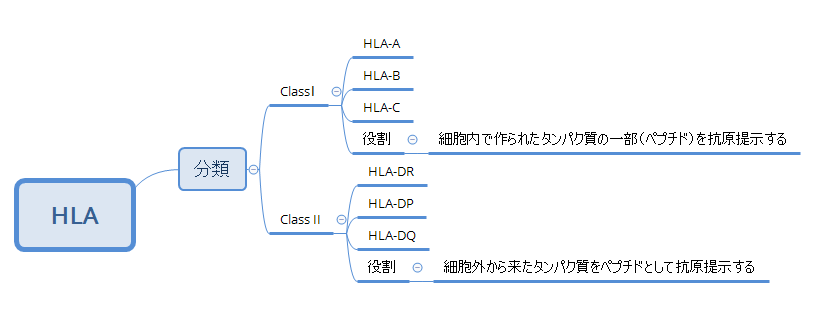
●HLA
●HLAホモ接合体
について補足しておきます。
●HLA・HLAホモ接合体について
HLAとは、体内のすべての細胞表面に存在するタンパク質で、免疫機構が働くときの目印となるものです。
以前は白血球のみにあると考えられていましたが、現在では体内のすべての細胞表面にあることがわかっています。
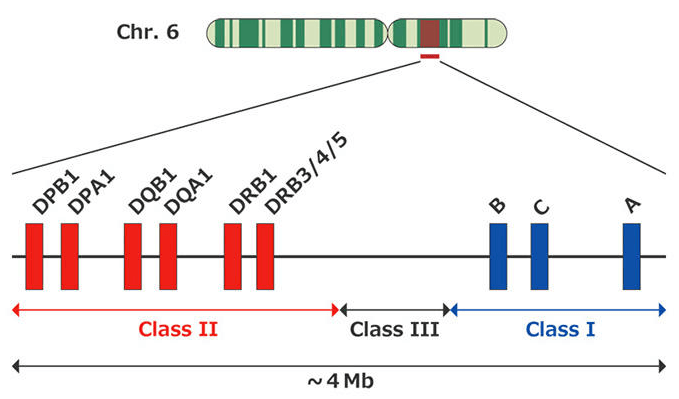
HLAをコードする遺伝子は、第6染色体短腕(Chr.6)上に位置します。
HLAは、機能や位置によって大きくクラスⅠ、クラスⅡに分けられ、さらに6つの領域に分類されます(下の赤色と青色)。
出典:veritastk.co.jp/hla/whatshla.html
遺伝子が位置する場所を「遺伝子座」といいます。HLA-Aが位置する場所をA座、HLA-Bが位置する場所をB座といいます。
HLAは次のように6つに分けられますが、各HLA遺伝子にはたくさんの種類があります。つまり、HLA-A、HLA-B・・・それぞれにたくさんの種類があるということです。
下の表からわかるように、HLA-Aだけでもかなりの種類ですよね。

出典:日本組織適合性学会(http://jshi.umin.ac.jp/abouthla/structure.html)
第6染色体上にあるシンプルなイラストに、実はどれだけの複雑性がひそんでいるか想像できますでしょうか?
HLAは自己と非自己を区別するためのものですので、これだけ多様で複雑であることは当然ともいえます。

出典:veritastk.co.jp/hla/whatshla.html
そして、両親それぞれから1対ずつHLA遺伝子を受け継ぐわけですが、受け継いだ2つの型が一致するものをHLAホモ接合体といいます。
具体的には、A座にはA1、A2、A3・・・・とありますが、両親それぞれからA1とA1を受け継いだ場合がHLAホモ接合体です。
一方で、A1とA3を受け継いだ場合は、HLAヘテロ接合体となります。
👇のイラストでは、HLA遺伝子座6つのうち、A座、B座、DR座を示しています。
ここでは、3つの遺伝子座の組み合わせが一致する「子3」がホモ接合体です。父親から②を、母親から③を受け継いでおり、②=③ですので、ホモ接合体です。

上記で①~④のように、各遺伝子で構成されるそれぞれのセットをハプロタイプといいます。
HLAの種類の多さから、ハプロタイプがどれだけ膨大な数にあるかおわかりいただけると思います。
その中で、自分と完全に一致するHLA型の人を見つけることが、どれだけ難しいかも想像できますね。
自分と完全に一致するHLA型の人を見つけられる確率は数万~数百万分の1といわれています。
つまり、HLAホモ接合体ドナーは非常にまれなのです。
そもそも、移植になぜホモ接合体が望ましいのか?というと、次のように、HLAホモ接合体の人から、HLA型の片方が同じ人への移植では拒絶が起こりにくいからです。
しかし、先ほど見てきたように、ホモ接合体ドナーを探しだすことは大変です。
そこで、iPS細胞研究所は、ヘテロ接合体ドナー由来のiPS細胞から、ゲノム編集技術を使って、拒絶リスクの低いiPS細胞を作製する方法を開発しました。
ゲノム編集技術を用いた拒絶されにくいiPS細胞の作製方法
ずばり、
HLA-Cを残し、HLA-AとHLA-Bの遺伝子を完全に壊しました。
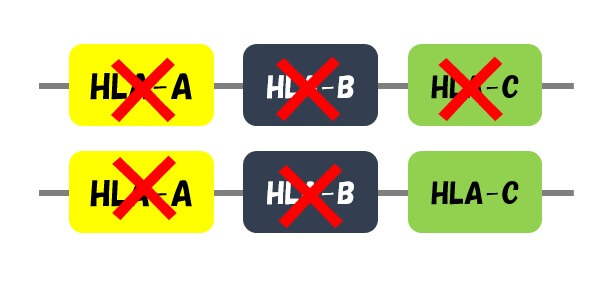
この方法で作製されたiPS細胞をドナー細胞とする場合、HLA-Cの型だけを合わせればすみます。
遺伝子を壊すのに使用したゲノム編集技術は、CRISPR-Cas9です。
CRISPR-Cas9は標的を狙いうちできるゲノム編集技術で、ガイド役のsgRNAが標的となる配列を見つけ出し、ハサミ役のCas9がDNAを切断します。
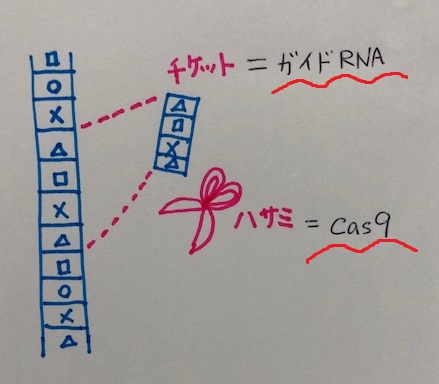
sgRNA(標的を見つけ出し、DNAに結合する)の設計を変えることで、好きな位置でゲノムを編集することができます。

ここで、HLA-Cだけを残すのには理由があります。
ミッシングセルフ応答(missing-self response)を防ぐためです。
簡単にいうと、自分を誤って攻撃しないように、HLA-Cを残します。
繰り返しですが、HLAは体内のあらゆる細胞表面に存在するタンパク質ですよね。
細胞表面にあるHLAは、正常な細胞を殺さないための安全装置になっています。
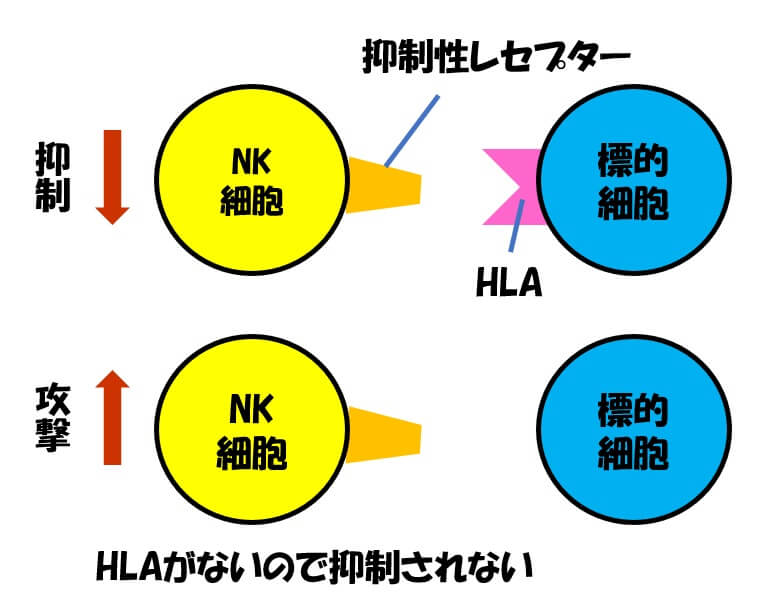
免疫を担うNK細胞には抑制性レセプターという受容体があり、HLAと結合すると、NK細胞の働きは抑制されます。
HLAがないと、細胞はNK細胞の抑制性レセプターに認識されず、NK細胞に攻撃されてしまいます。たとえそれが自分の細胞であっても、です。
このように、自己の標識を持っていない細胞を異物と認識する反応をミッシングセルフ応答(missing-self response)といいます。
標識をもたない細胞を攻撃するNK細胞の働きは、T細胞やB細胞が抗原を認識して攻撃をしかけるのとは対照的ですよね。
細胞のHLA遺伝子をすべて壊してしまうと、ミッシングセルフ応答(自分の細胞であることをわからずに攻撃する反応)が起きてしまうため、HLA-C遺伝子をあえて残しておく必要があるのです。
HLA-Cの遺伝子だけを残した細胞では、T細胞の攻撃を回避できること、NK細胞の攻撃を受けにくいことが結果で示されました。
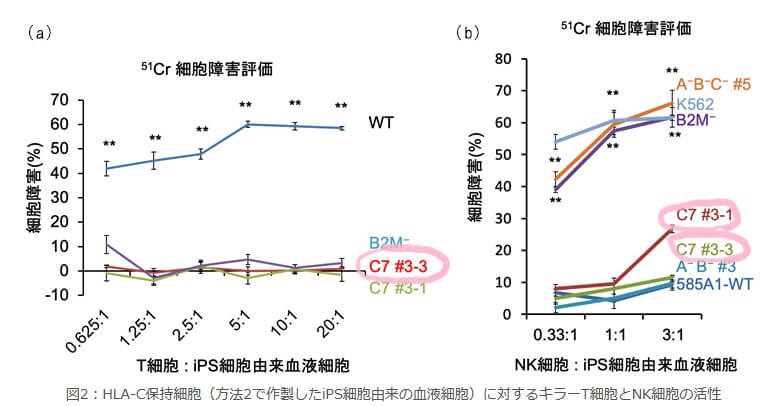
出典:ゲノム編集技術を用いて拒絶反応のリスクが少ないiPS細胞を作製
さらにマウス体内に移植したときの細胞の生存率を比較した結果がこちら。
ゲノム編集していない細胞(WT)と、HLA-Cのみ残した細胞(C7)の比較です。
青色の部分が生きている移植細胞を示しています。HLA-Cを残したゲノム編集細胞では、7日後も高い割合で生存率を維持しているのがわかります。
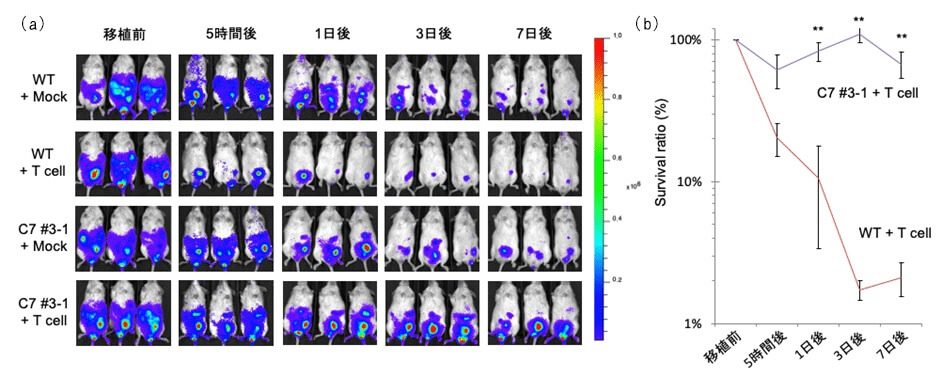
出典:ゲノム編集技術を用いて拒絶反応のリスクが少ないiPS細胞を作製
この研究成果が発表された2019年4月の論文「Targeted Disruption of HLA Genes via CRISPR-Cas9 Generates iPSCs with Enhanced Immune Compatibility.」には、次の記載があります。
We estimated that 12 lines of HLA-C-retained iPSCs combined with HLA-class II knockout are immunologically compatible with >90% of the world’s population, greatly facilitating iPSC-based regenerative medicine applications.(論文アブストラクトより)
”HLAクラスⅡ欠損+HLA-C残存iPS細胞”であれば、12株で世界全人口の90%以上をカバーできると推定される
ただ、バイオジャパン2019のセミナー「iPS細胞研究アップデート」での山中先生のお話では、
ホモ接合体由来iPS細胞4株に加え、ヘテロ接合体由来の10株で世界の人口をカバーできるだろうとのことでした。

これは論文発表時から研究が進んでいるということかもしれませんね。
そして、最終目標は自家移植の実現です。
ただ、ゲノム編集技術を利用するかに限らず、再生医療に使うiPS細胞については、発がんの可能性のあるゲノム変異を取り除く、という課題もあります。
CRISPR-Cas9によるオフターゲット効果(標的以外の部位に意図しない変化が起こること)による変異のリスクも、気になるところです。
今回の研究成果は、iPS細胞をタイムリーかつ大量に臨床に応用させる上で貴重な成果だと思います。
セミナー前に事前にしっかり予習できていれば、もっと深く理解できたと思います。
もっと情報を知りたくて読まれた方には申し訳ない限りですが、来年のiPS細胞研究アップデート(山中先生の有料セミナーは毎年あるようです)では、より突っ込んだ報告をさせていただきます。
(今回はセミナーの時間帯が遅く、中座しなければなりませんでした)。
来年の目標は、会場からの質問に挙手して、山中先生に直接質問することです。
【参考】
Targeted Disruption of HLA Genes via CRISPR-Cas9 Generates iPSCs with Enhanced Immune Compatibility.
ゲノム編集技術を用いて拒絶反応のリスクが少ないiPS細胞を作製