【テロメアとテロメラーゼ】末端複製問題をどのように解決するのか? ー多能性幹細胞の安定培養にも-
以前の記事で、DNA複製時に2本鎖が解離して新たに合成されるDNAのうち、連続的に合成される鎖をリーディング鎖、断片的に合成されたものが連結した鎖をラギング鎖と書きました。
今回は、真核細胞のラギング鎖で起こるある問題をどうやって解決しているのか?という点に着目しつつ、再生医療に関するテロメアの研究事例を一部ご紹介します。
目次
ラギング鎖の末端複製問題
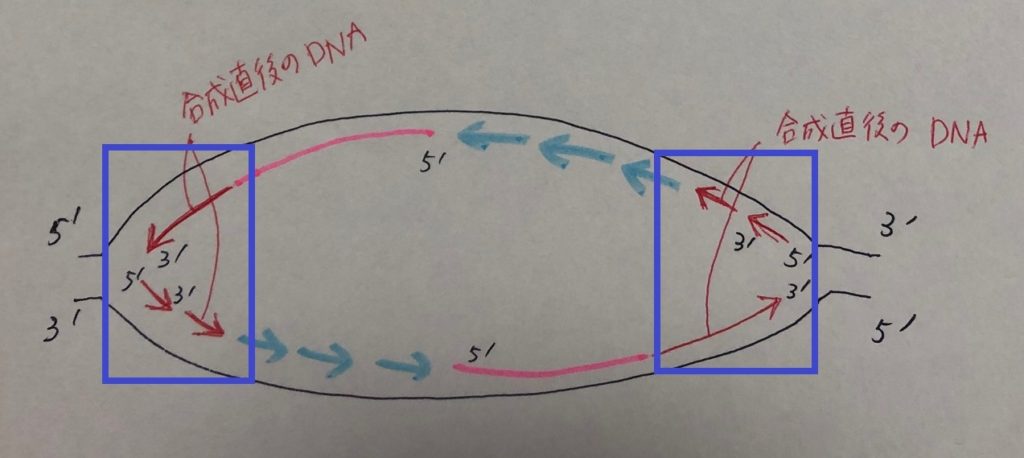
DNA複製時、下図のように複製フォークが両方向に移動していきますよね。

二本鎖がほどかれていくとき、合成直後の新しいDNAは下図にあるように、赤色の線で描いた部分(青枠)になります。
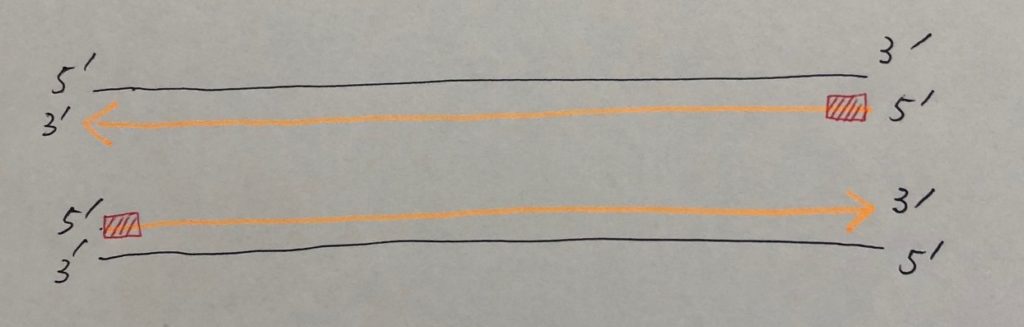
ラギング鎖では、複製フォークが進むにつれ、形成される新しいプライマーからDNAが合成されていきます(上図の赤い短い矢印)。
複製が進み、1本鎖の各プライマーがDNAに置き換えられて連結したとき、最末端部分は欠けた状態になっています(下図の赤色)。最末端部分にDNAを合成したくても、新たなプライマーをつくる場所がありません。
これを時系列でわかりやすくしたのがこちらの画像です。
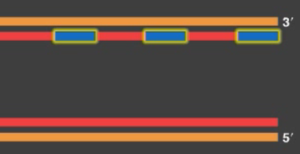
出典:エッセンシャル細胞生物学附属DVDのスクリーンショット
↓

出典:エッセンシャル細胞生物学附属DVDのスクリーンショット
↓

出典:エッセンシャル細胞生物学附属DVDのスクリーンショット
このように、ラギング鎖の複製では、コピーするDNAよりも長い鋳型が必要になります。そうでないと、上図のように、鋳型末端よりも短い位置で複製が終了してしまいます。
このままでは、染色体は徐々に短くなり、遺伝情報を失ってしまいます。これを末端複製問題といいます。
上記の流れは参考書を目で追っているだけではよくわかりませんでしたが、手で書いてみることで納得できました。
真核細胞におけるテロメラーゼ
細菌では、染色体を環状にしているため末端複製問題は存在しません。
では、真核細胞はどのように末端複製問題を解決しているのでしょうか?
ここで、染色体の両末端にあるテロメアという部分に注目。テロメアは決まった繰り返し配列を持つ部分です。
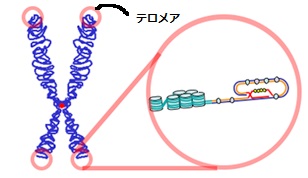
出典:wikimedia commons
テロメアには次の2つの働きがあります。
①染色体末端を保護する
②染色体末端の複製を完了させる
ここでは②に注目します。
末端複製問題の解決方法をざっくりいうと、
テロメア配列にテロメラーゼという酵素がやってきて、テロメアを伸長させます。ラギング鎖のDNA合成と同様に、伸長されたテロメアを鋳型としてDNAを合成することで、染色体末端が短くなるのを防いでいます。
つまり、足りない鋳型部分を、テロメラーゼというお助け隊が伸ばしてくれるわけですね。
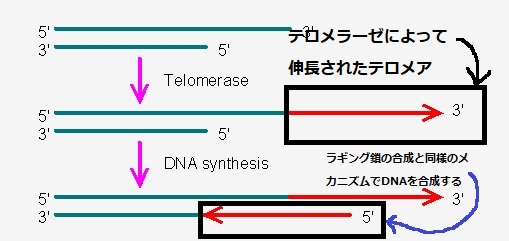
もう少し詳しくみたのがこちら。染色体末端のテロメア(上の1本鎖)と、不完全なラギング鎖(下の1本鎖)を拡大した図です。
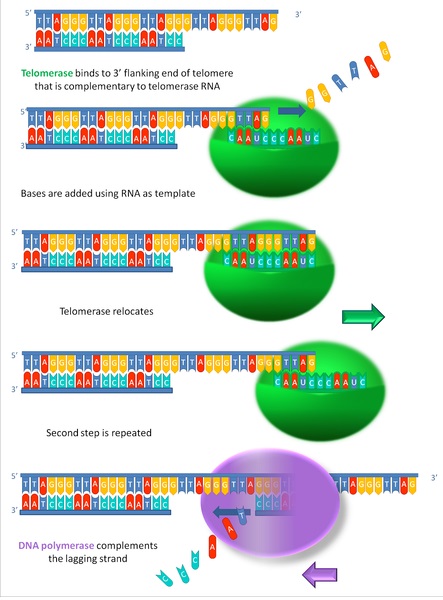
出典:wikimedia commons
ここでテロメアDNAの「TTAGGG」は、ヒトを含む哺乳類でのテロメアの繰り返し配列です。テロメアをよくみると、「TTAGGG」の繰り返し配列であることがわかります。
テロメア配列に相補的なRNA配列を持つテロメラーゼ(図で緑色)がやってきて、自身のRNA鋳型をもとにテロメア配列を伸長させていきます。DNAポリメラーゼ(図で紫色)は新たにできたテロメア配列を鋳型として、DNAを合成し、ラギング鎖の複製を完了することができます。
このようにして末端複製問題を解決しているのを知ったときは驚きました。
ラギング鎖の返し縫いによる複製といい、テロメラーゼの働きといい、生命を学べば学ぶほど、神の存在を考えてしまいます。
ちなみにテロメラーゼは老化に関係すると言われており、分化した体細胞には発現していません。一方で、生殖細胞、幹細胞、がん細胞には発現しています。
次は、テロメアの研究がES細胞やiPS細胞など安定的な培養につながるかも!?というテーマの研究をご紹介します。
多能性幹細胞の老化回避にかかわるテロメアの働き
ES細胞、iPS細胞の半永久的に増殖を繰り返すメカニズムを解明するために、理化学研究所はマウスES細胞の細胞周期とテロメア長に着目しました。
この研究のポイントをまとめると、

出典:理化学研究所
これまで、マウスES細胞ではZscan4というタンパク質がテロメアを伸長させることがわかっていました。しかし、Zscan4はすべてのES細胞にいつでも発現しているわけではなく、どのようなときに発現するかまでは解明されていませんでした。
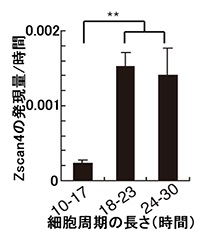
研究グループは、マウスES細胞の細胞周期のばらつきに着目しました。ES細胞の細胞周期の長さは均一だと考えられていましたが、実際には10~30時間と大きなばらつきがありました。
テロメアが短くなったり、DNAの損傷が起こると、修復のために細胞周期が一時的に停止し、細胞周期が長くなる傾向があります。研究では、細胞周期が長いほどZscan4の発現量が多く、細胞周期が長いES細胞では、テロメアが短くなっていることがわかりました。
出典:理化学研究所

出典:理化学研究所
この結果より、テロメアが短くなるとZscan4が多く発現され、テロメアの長さを元に戻していることが示されました。
多能性幹細胞の分化の不均一性の制御や解明につながりそうですね。
老化メカニズムの研究にも(コーセー)
老化メカニズムの研究にテロメアを活用したコーセーの研究も興味深いです。
高齢者の皮膚から採取した線維芽細胞と、同線維芽細胞から作製したiPS細胞、このiPS細胞から誘導した線維芽細胞とで、テロメア長を比較しています。
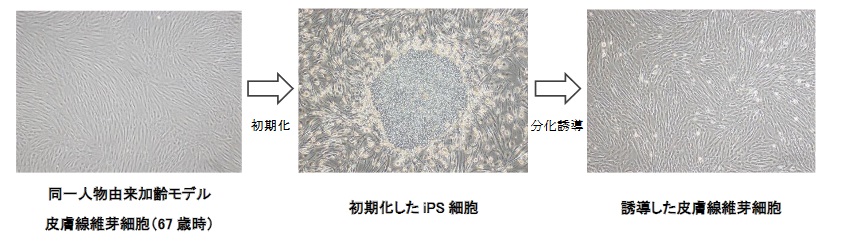
出典:Kose
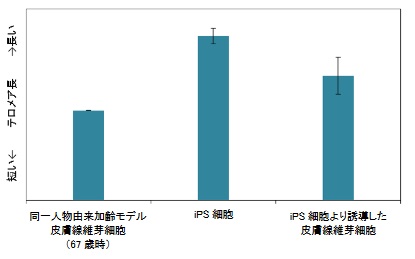
結果、iPS細胞でテロメア長が最も伸長していました。iPS細胞から誘導した線維芽細胞は、元の細胞よりもテロメア長が伸長していました。
出典:Kose
テロメアは加齢とともに短縮するので、初期化することで細胞が若返っているのがわかりますね。
まとめ
テロメアに関する研究はまだ一部しか確認していませんが、幹細胞の分化とテロメアの関係性に着目した理研の研究に特に興味を持ちました。
テロメラーゼはがんの治療薬やメカニズムでも研究されていますね。
テロメアが伸長される仕組みは、エッセンシャル細胞生物学に附属のDVDがとてもわかりやすかったです。
なぜかYouTubeにも同じ動画がありました。
【参考】
ES細胞の老化回避機構を解明 -再生医療への多能性幹細胞の安定供給を目指して-