翻訳後修飾をわかりやすく説明!【糖鎖修飾とリン酸化をクローズアップ】
こんにちは、あゆみです。
DNAの転写・翻訳を経て合成されるタンパク質。タンパク質合成は、実は翻訳で終わりではありません。
タンパク質が機能を発揮するためには、もう一つステップを踏む必要があります。それを翻訳後修飾といいます。
文字通りですが、教科書だけ読むと「だから何なの?」と思ってしまいますよね。
今回は、翻訳後修飾をわかりやすく説明するとともに、日本人の多くの人が関心のある血液型のお話から、疾患治療への応用などについてご紹介したいと思います。
翻訳後修飾が意外に身近なところにあることを知っていただけたら嬉しいです。
目次
翻訳後修飾をわかりやすく説明
繰り返しになりますが、
翻訳後修飾とは、タンパク質の機能を多様にするメカニズムのことです。
転写・翻訳されて合成されたタンパク質は、そのままでは機能を発揮することは少ないのです。タンパク質が機能を発揮するためには、翻訳後修飾というプロセスが必要になります。
このプロセスによって、タイプのことなるものに変身したり、DNAに情報を伝える機能がONになったりします。
女性によって、濃いめのメイク、薄いメイクの好みが違ったり、TPOの応じてメイクを変えたりするよう、タンパク質も状況に応じてメイクの仕方を変えています。
このメイク(=翻訳後修飾)のバリエーションは300種類以上あると言われています。
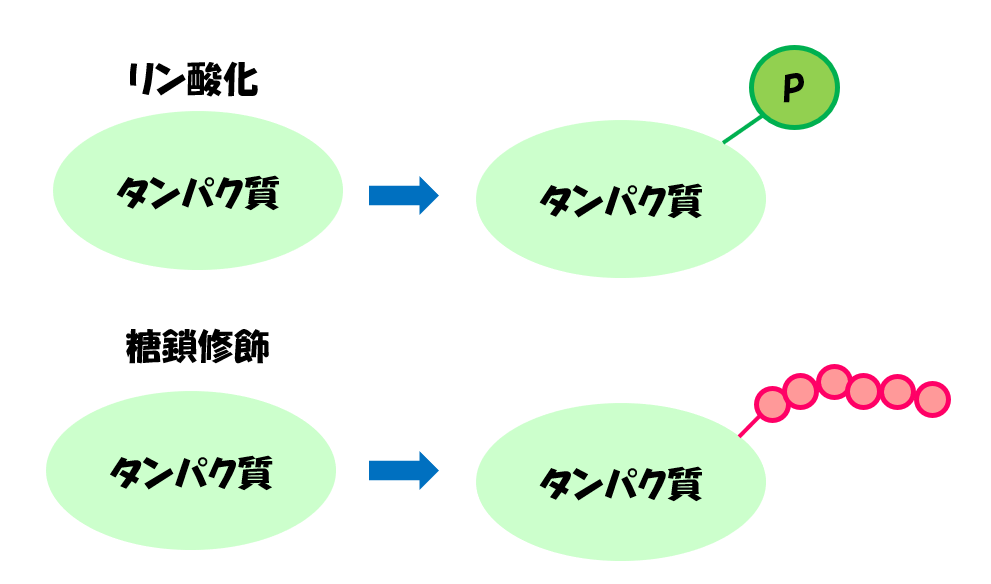
その代表的なものが、糖鎖修飾とリン酸化です。

翻訳後修飾の1つ:「糖鎖修飾」
実はタンパク質の約50%に糖鎖がついています。
血液型も糖鎖修飾
一番わかりやすいものは、血液型でしょうか。
血液型診断が好きな方、たくさんいらっしゃいますよね。A、B、AB、Oという4タイプの血液型。違いを生み出しているのは、赤血球表面にある糖鎖の種類の違いにすぎません。
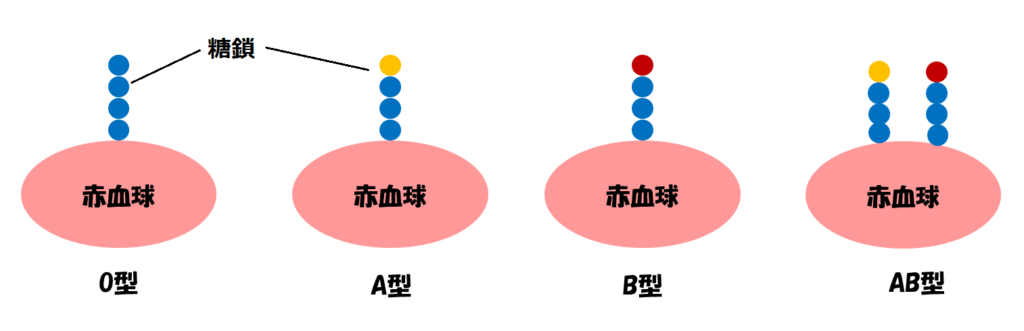
赤血球についている糖鎖、これも翻訳後修飾の1つです。
がん細胞でみられる糖鎖修飾
正常細胞とがん細胞では、タンパク質の糖鎖に違いがあり、がん細胞では余分な糖鎖がついて、糖鎖の先が枝分かれしていることが報告されています。
バイオマーカー「ヘモグロビンA1c」
このほか、疾患の状態を確認するうえでも役立つのが翻訳後後修飾です。
誰もが知っている糖尿病。血糖値は、食事によって変動するため、1回の血糖値だけでは糖尿病であると診断できません。
そこで、有効なのが、過去1~2ヵ月の血糖値を確認できるヘモグロビンA1c(HbA1c)というバイオマーカー。
HbA1cは、ヘモグロビンに糖が結合したものです。

出典:疾患に関連したタンパク質翻訳後修飾に関する研究
ブドウ糖に依存して増えるHbA1cは、疾患の診断や生体状態を知ることのできる代表的な翻訳後修飾の1例です。
HbA1cは以前は重要視されていませんでしたが、2010年の診断基準改定で格上げされたバイオマーカーです。以前は必ず2回検査が必要だったのですが、HbA1cと血糖値の同時測定により1回の検査で診断可能となりました。
膵がん治療への活用
がん細胞にくっついた糖鎖を利用して、がんを治療する研究が進められていいます。がんの中でも、膵がんは治療が難しいがんですよね。
2年前の研究成果ですが、筑波大学の下村先生方は、膵がん細胞表面にある糖鎖に着目しました。
がん細胞のタンパク質ではなく、がん細胞表面に飛び出ている糖鎖を狙い撃ちしようと考えたのです。
そこで利用したのが、糖鎖に結合するタンパク質であるレクチン。
ㇾクチンは、動物、植物、微生物から、安価に生産できることが特徴です。
出典:「膵がん細胞表面の糖鎖をレクチン融合薬で狙い撃ち」を改変
膵がん表面の糖鎖に特異的に結合するレクチンと、抗がん剤を融合させた、レクチン-薬剤融合体(LDC)を作成し、マウス膵がんモデルに投与しました。治療に成功したほか、マウスに投与しても、レクチン投与で心配される血液凝集は見られませんでした。
この研究では、膵がん表面にいる糖鎖に特異的に結合するレクチンを使いました。このレクチン以外にもがん細胞に特異的に結合するレクチンを見つけられれば、ほかのがんに対する標的治療にも活用できそうですね。
ここまでのまとめ
翻訳後修飾とは、タンパク質の機能を多様にするメカニズム(≒女性がおしゃれするのと似ている)
翻訳後修飾の代表的なものは、糖鎖とリン酸化
糖鎖修飾の最も身近な例は、血液型
糖鎖は、がん細胞の糖鎖を狙い撃ちにする標的治療にも活用される
次はリン酸化についてみていきます。
翻訳後修飾の1つ:「リン酸化」
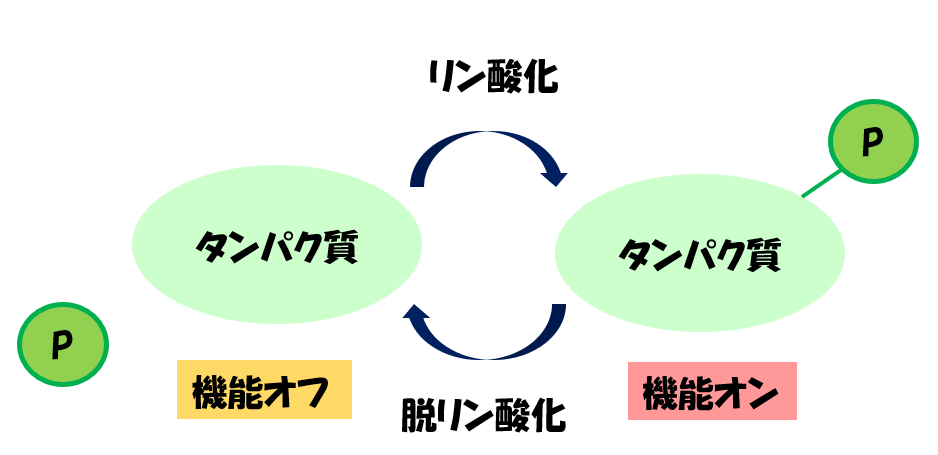
タンパク質にリン酸が付加されることをリン酸化といいます。
リン酸化されると、タンパク質の機能がオフ状態からオン状態に変化します。

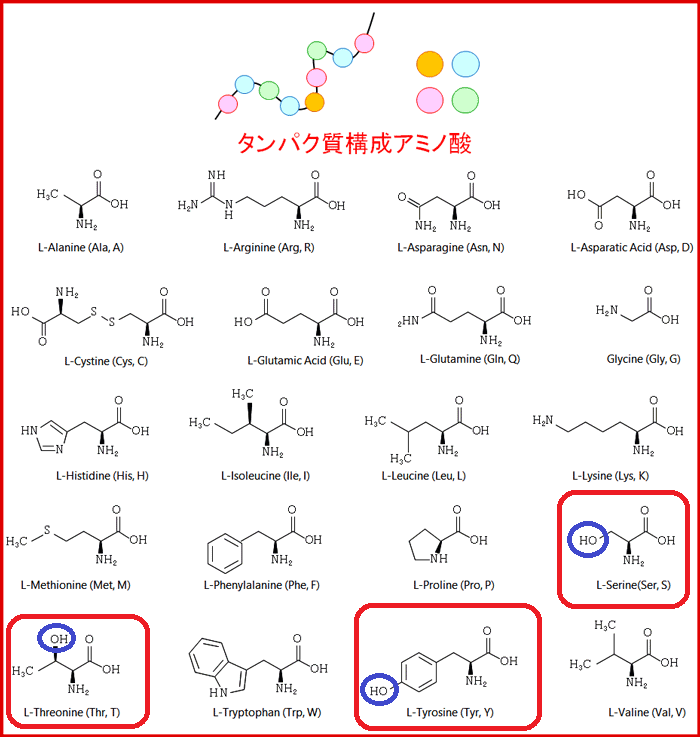
タンパク質の約1/3がリン酸化されており、リン酸化はタンパク質を構成する次の3つのアミノ酸で起こります。
この3つのアミノ酸にリン酸が付加されるとタンパク質の機能が、上図のようにオフからオンへ切り替えられます。
セリン、トレオニン、チロシンでリン酸化が起こる理由
20種類あるアミノ酸のうち、なぜセリン、トレオニン、チロシンの3つでリン酸化が起こるのか不思議に思いませんか?
結論は、ペプチド結合に関与しない側鎖に求核性のヒドロキシ基があるためのようです。
求核性ときくと、「うっ」となりますよね。
求核性とは、自分が余分に持っている電子を、電子不足な状態にいる誰かに与えたくて、ついおせっかいしてしまう性質のこと。
そのおせっかいが、相手から見たら「攻撃された」とうつります。いらないのに電子を押し付けてきやがって、という感じです。
アミノ酸20種類のうち、セリン、トレオニン、チロシンを赤枠で囲みました。
出典:日本分光株式会社(https://www.jasco.co.jp/jpn/technique/topics/amino/about.html)
3つの構造をクローズアップ。
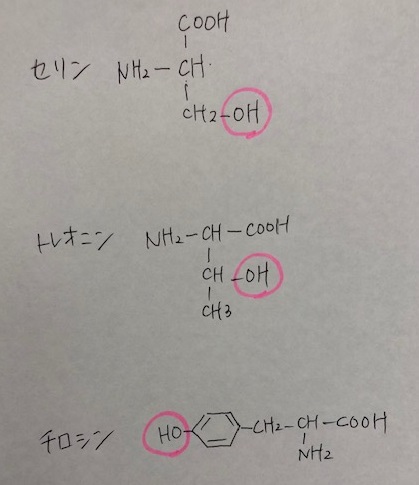
確かに、アミノ酸側鎖に求核性のヒドロキシ基「-OH基」がありますね。
しかし、ほかのアミノ酸にも、ローンペア(他の原子と手をつなげずにいる電子対)を持つカルボキシル基(-COOH基)、アミノ基(-NH2基)があり、なぜ上記アミノ酸の3つだけ?と疑問がわいてきます。
しかしよく考えてみると、タンパク質というのは、アミノ酸がペプチド結合(アミド結合)によって結合していますよね。
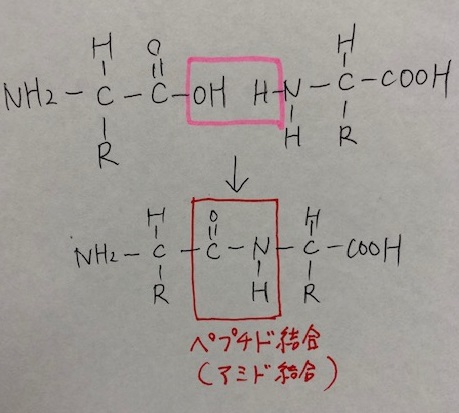
ペプチド結合(-CO-NH-)は、下記のような共鳴構造をとるため、電子が分子内を動く=攻撃性が弱まる=求核性は低いということになります。
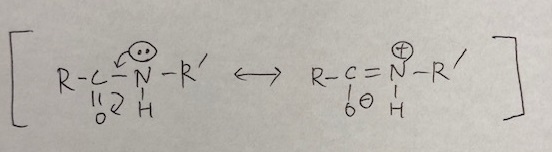
👇静電ポテンシャルマップで示したものを見ると、わかりやすいと思います。
ペプチド結合を形成する前の-COOHと-NH2は電子が豊富にありますが、ペプチド結合を形成した後は、電子密度が低くなっていますね。これはまさに上図で示した共鳴構造をとっているためだと考えられます。
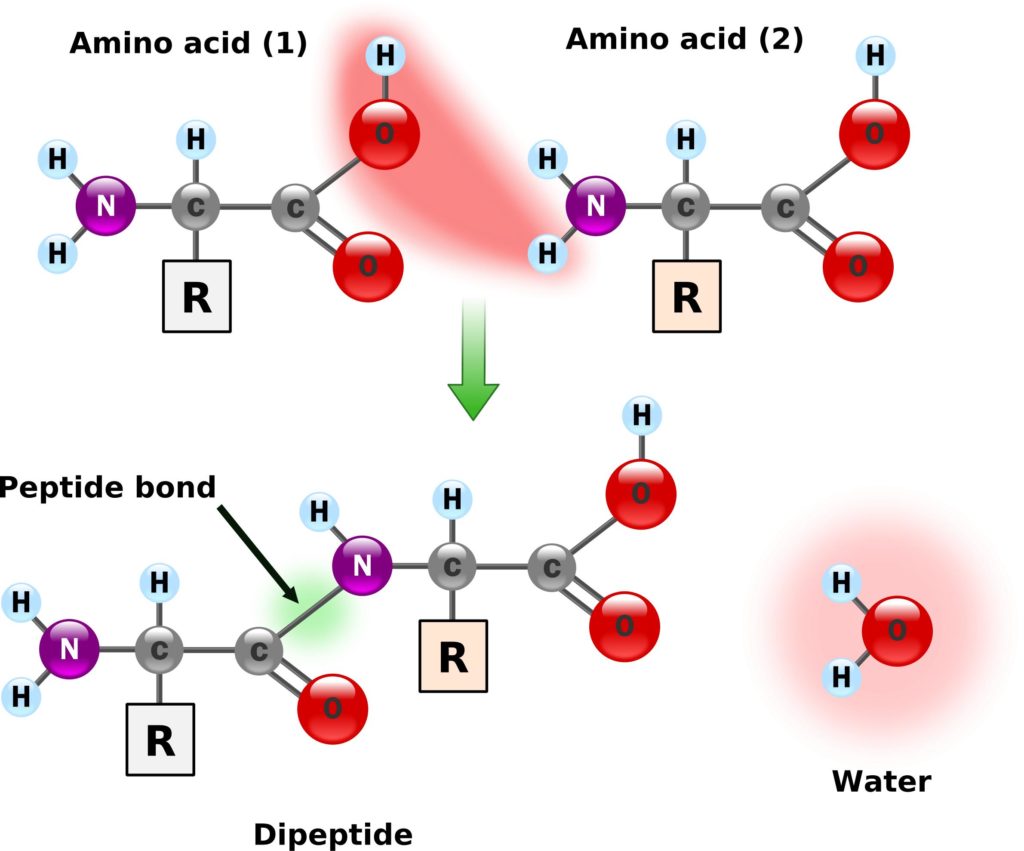
Peptide Bond Formation PNG image(出典)
では、ペプチド結合に関与しない、あまったカルボキシル基(-COOH基)はどうなるの?というと、カルボキシル基も共鳴構造をとりました。
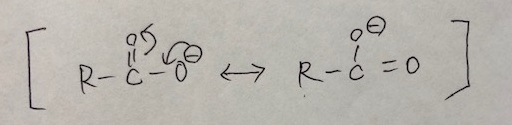
つまり、ペプチド結合と同様に、求核性は低いことになります。
さらにペプチド結合に関与しないアミノ基(-NH2)については若干疑問が残りますが、ペプチド結合に関与しないアミノ基(-NH2)を持つアミノ酸以上に、セリン、トレオニン、チロシンの側鎖にあるヒドロキシ基(-OH基)の方が数が多いからではないかな?と思います。
求核性はアミノ基(-NH2)>ヒドロキシ基(-OH基)ですが、数の違いなのかなと考えています。
長く脱線しました。こういうことを考え始めると時間を忘れてしまいます。
ということで、セリン、トレオニン、チロシン側鎖の-OH基による求核置換反応によって、タンパク質がリン酸化されることがわかりました。

出典:ThermoFisher リン酸化のメカニズム
多くのがんは、リン酸化の異常によって起きると考えられています。
タンパク質のリン酸化によって、外からの情報がDNAに伝えられますが、リン酸化のプロセスで異常が起こると、誤った情報がDNAに伝えられてしまいます。
多くのがん細胞では、シグナル伝達に関わるタンパク質のリン酸化が亢進されていることが報告されています。
どうでしょうか。翻訳後修飾について、少し興味がわきませんか。病気に関係しているのが興味深いですよね。
ここまでのまとめ
タンパク質のリン酸化異常は多くのがんの原因となっている
タンパク質のリン酸化は、セリン、トレオニン、チロシンで起こる
セリン、トレオニン、チロシンに限定してリン酸化が起こるのは、側鎖のヒドロキシ基(-OH基)がもつ求核性による
まとめ
タンパク質の翻訳後修飾としては、今回ご紹介した以外にも、アセチル化、メチル化、ユビキチン化などがあります。
病気の原因となる遺伝子をみつけるためにゲノム解析が行われますよね。ゲノムとはある生物のすべての遺伝情報を表す言葉です。
関係図を示すと、次のとおりです。
ゲノム>DNA>遺伝子

出典:http://www.differencebetween.info/difference-between-gene-and-genome
遺伝子をすべて含むDNA、
DNAが染色体を構成し、染色体がすべてあつまったのがゲノム
という感じでしょうか。混乱しますね。
タンパク質でゲノムに対応する言葉を、プロテオームといいます。体内のすべてのタンパク質ですね。ゲノム解析と同様に、プロテオーム解析も重要視されています。
疾患の解明や、治療薬の開発などで研究が進んでおり、すごく奥深い学問ですね。
【参考】
疾患に関連したタンパク質翻訳後修飾に関する研究