【イントロンが存在する理由】2019年の最新知見もあわせてご紹介
mRNAがつくられる過程では、イントロンが取り除かれ、エキソンだけが残されます。
エキソンとは、タンパク質つくる情報を持つ配列、
イントロンとは、タンパク質をつくる情報を持たない配列のことをいいます。
未成熟なRNAからイントロンを取り除き、エキソンをつなぎあわせて成熟したmRNAをつくります。
遺伝子がエキソンとイントロンで分けられる配列は、真核細胞にだけ見られるものです。
では、イントロンはなぜ存在するのでしょうか?イントロンの役割はなんでしょうか?
イントロンの3つの役割をひとことでまとめてみました。
さまざまなタンパク質を効率につくる
新しいタンパク質をつくりだす
生存に関与する
3つ目は、2019年1月に発表された知見です。
細かく見れば他にもあると思いますが、今回はこの3つの役割をご紹介します。
スプライシングのおさらい
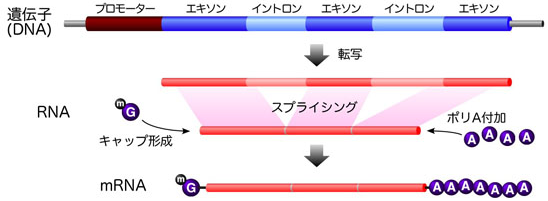
mRNA前駆体が成熟したmRNAになるとき、スプライシングというプロセスを経ます。
≪補足≫ mRNA前駆体とは?
DNAが転写されてRNAが作られるとき、最初に作られる未成熟なRNAのことです。
これは真核細胞だけにあるものです。
繰り返しになりますが、
DNAには、タンパク質を作る情報を持つエキソン(エクソンともいいます)、
タンパク質を作る情報を持たないイントロンがあります。
出典:分子遺伝学研究所
mRNA前駆体にはDNAと同様に、エキソン、イントロンが存在します。
mRNA前駆体からイントロンを取り除くことをスプライシングといいます。
スプライシング:mRNA前駆体からイントロンを取り除くこと
実際は、このようにスプライソソームという巨大な複合体が、イントロン特有の目印となる配列を見つけてイントロンを攻撃し、イントロンは投げ縄構造の形で切り取られます。
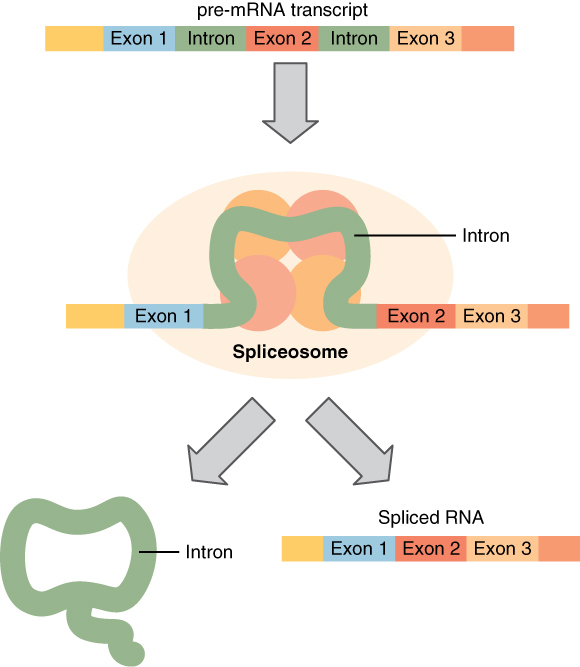
出典:opentextbc.ca
では、最終的にイラナイものとして取り除かれるイントロンは、なぜ存在するのでしょうか?
イントロンが存在する理由
これまでわかっていたイントロンの役割として、次の2つがありました。
・同じ遺伝子からさまざまなタンパク質を効率的につくる
・既存のエキソンを組み合わせて、新しいタンパク質をつくる
同じ遺伝子からさまざまなタンパク質を効率的につくる
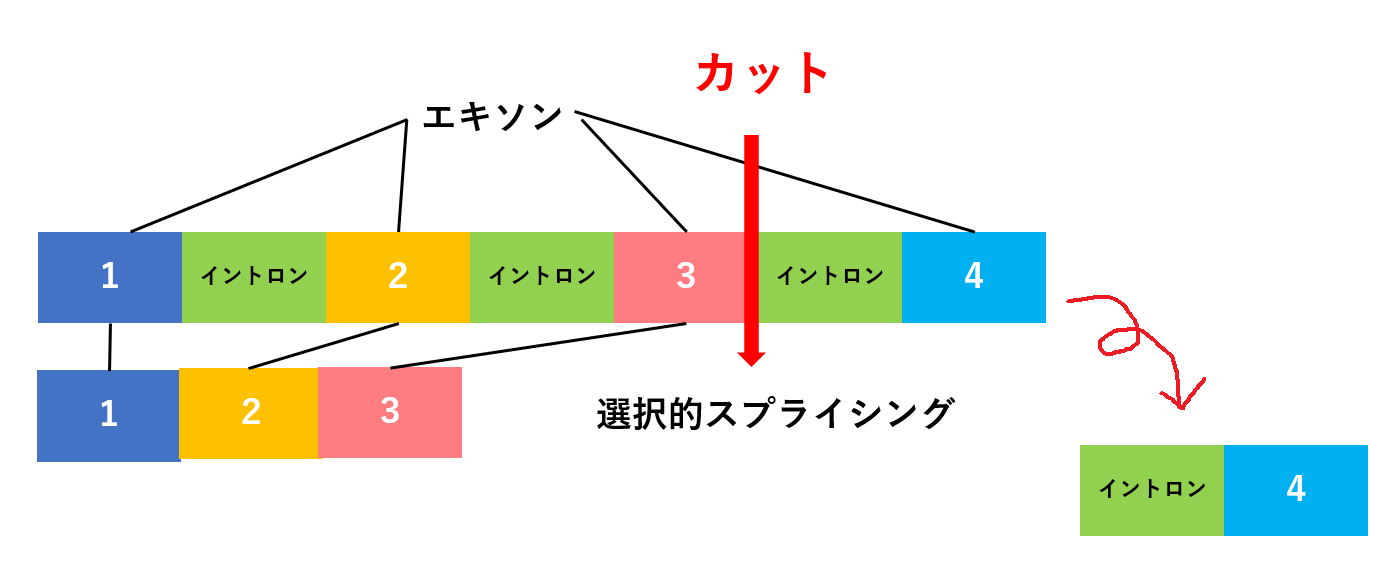
遺伝子からイントロンが取り除かれるパターンには大きく2つあります。
1つのDNAからイントロンをすべて取り除くことを恒常的スプライシングといいます。
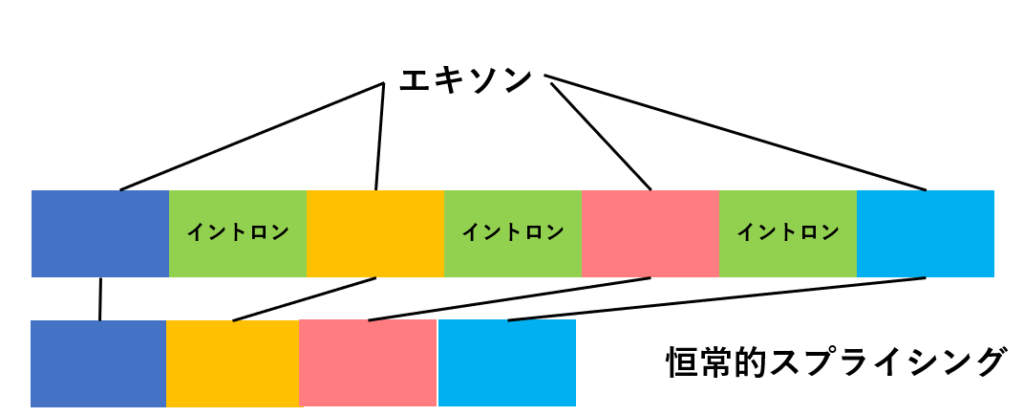
これに対し、
1つのDNAからイントロンを取り除くとき、取り除き方にバリエーションを加えたものを選択的スプライシングといいます。
たとえば、👇の例では、エキソン1+エキソン2+エキソン3がつなぎ合わされ、エキソン4はイントロンとともに除外されています。
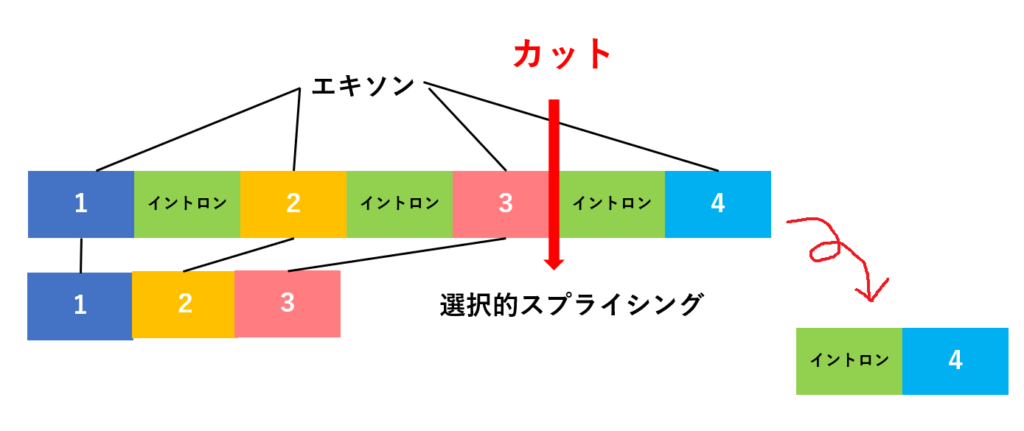
👇この例では、エキソン2がイントロンとともに除外され、エキソン1+エキソン3+エキソン4がつなぎ合わされた配列が形成されます。
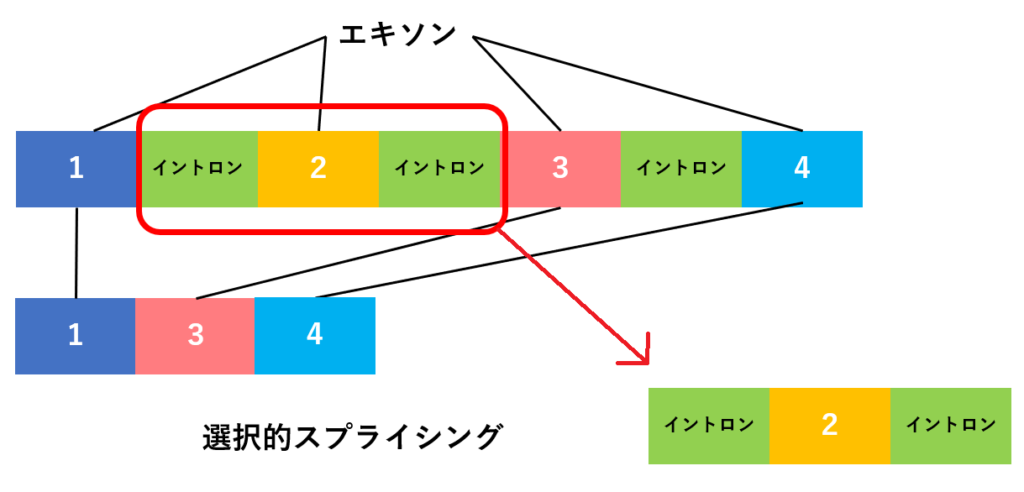
このように、1つのDNAからタンパク質をつくるとき、何通りかのスプライシングがあります。
1つのDNAから複数のmRNAをつくる選択的スプライシングによって、1つのDNAからさまざまなタンパク質を効率的につくれるわけです。
既存のエキソンを組み合わせて、新しいタンパク質をつくる
イントロンの2つ目の役割は、
別のエキソンに入れ替えることで、新しい遺伝子をつくりだすこと
と考えられています。
👇のように、エキソン(緑色)が遺伝子内部で入れ替わるイメージです。
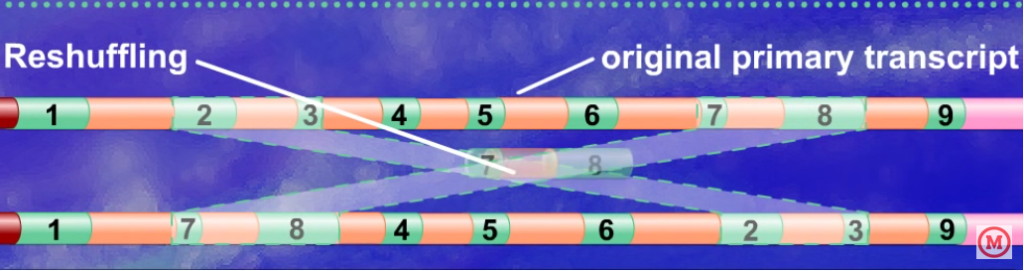
出典:https://youtu.be/rMa3i8xz5nU
主な根拠として、2つの事実があります。
根拠その①:タンパクドメインは各エキソンからつくられる
エキソンとイントロンの境界が、その遺伝子によってつくられるタンパク質内のドメインの境界と一致することがあります。
これ、ちょっとわかりにくいですよね。
ドメインというのは、タンパク質という大きな三次元構造体においてそれ自体が独立した機能を持つ領域をいいます。
学校のクラスに、それぞれの班があるイメージです。
クラス=巨大なタンパク質
班=ドメイン(独立した役割を持つ)
それぞれのエキソンは、タンパク質の単位構造に相当するドメインに対応していることが多いのです。
たとえば、👇の図は、ある遺伝子のエキソンA、エキソンBと、別の場所にあるエキソンYが組み合わさって、エキソンA+エキソンB+エキソンYという配列をつくりだしています。
そして、それぞれのエキソンからドメインA、ドメインB、ドメインYがつくられます。
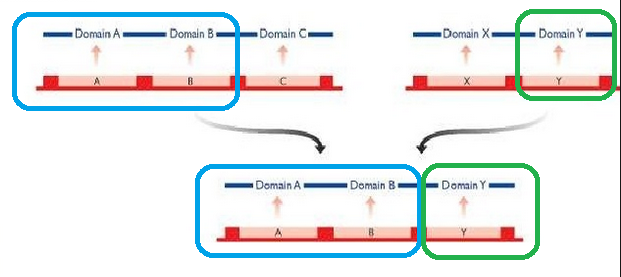
出典:https://www.slideshare.net/ruchibioinfo/genome-origin
つまり、タンパク質の構造を調べてみたところ、
➡基本単位となるドメインには、それぞれ対応するエキソンがあった
➡多種多様なタンパク質は、エキソンが入れ替わることによって実現した
と考えられている、ということですね。
もう少しシンプルにしたのがこちら。モジュール=ドメインです。
ドメインが入れ替わって、異なるタンパク質ができるイメージを示しています。

出典:実験医学online
根拠その②:たがいに関連のない遺伝子が同類のエキソンを持っている
下図の上は、LDL受容体遺伝子が18個のエキソンを持つことを示しています。
LDL受容体遺伝子は、EGF遺伝子にみられる9個のエキソンに似たエキソンと、C9補体遺伝子にみられる5個のエキソンに似たエキソンから成り立っています。
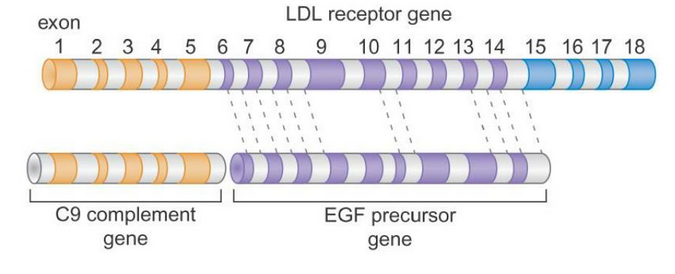
出典:https://www.slideserve.com/ismail/rna-splicing
これは、エキソンが別のタンパク質の遺伝子で再利用されている証拠とされています。
エキソンがイントロンによって分割されているおかげで、特定の配列をカット➡つなぎ合わせて新しい遺伝子をつくれる、
ということが可能になっているわけですね。
なんだか、レゴブロックを積み重ねていろいろなものを作り出すイメージに似ていますね。

イントロンの役割をまとめると次のとおり。
・スプライシングのやり方を変えることで、さまざまなタンパク質を効率的につくる
・エキソンを入れ替えることで、新しいタンパク質をつくる
2019年に見いだされたイントロンの新たな役割
さきほどお話したのは、エッセンシャル細胞生物学やワトソン遺伝子の分子生物学にも書かれていることですが、イントロンの役割については新たな知見が得られています。
2019年1月に発表されたネイチャーの論文で、イントロンの新しい知見が見出されました。
出芽酵母を使った実験で、
イントロンが細胞の生存に関わっていることがわかったのです。
実験内容
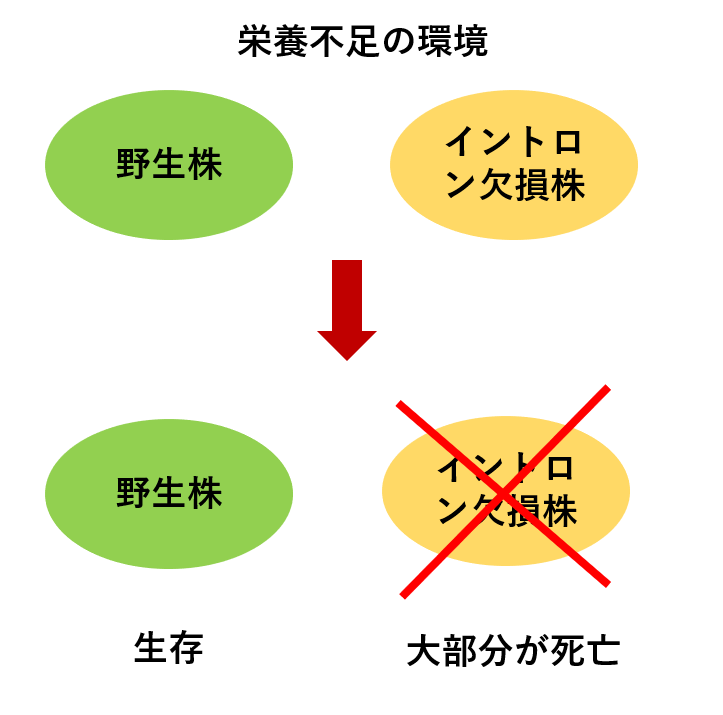
・イントロンを1つ欠損させたさまざまな酵母と野生株を栄養不足の状態にしたところ、野生株は生存したが、イントロン欠損酵母は64%が死亡した。
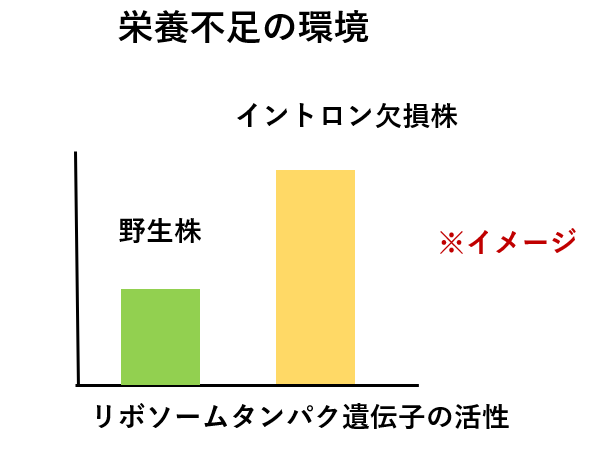
・栄養不足の環境におかれた時、野生株よりも欠損酵母でリボソームタンパク遺伝子の高い活性を認めた。
・栄養不足の環境におかれると、エネルギーを節約するために細胞はリボソームタンパク遺伝子を抑制するが、イントロン欠損酵母では抑制を認めなかった。
研究グループの結論
・イントロンを持つ正常な細胞を栄養不足の環境におくと、エネルギーを節約するために、イントロンがリボソームタンパク遺伝子を抑制する
情報をまとめると次のとおり。
イントロンが1個欠損
➡リボソームタンパク遺伝子の活性が高い
➡タンパク質がより作られる
➡エネルギーが使われる
➡生存に不利
イントロンがある
➡リボソームタンパク遺伝子の活性が低い
➡タンパク質合成が低下する
➡エネルギーを節約する
➡生存に有利
つまり、飢餓状態におかれたとき、生存のためにイントロンがタンパク質合成を抑制し、エネルギーを節約する方向に働くことが見出されました。
イントロンが細胞の生存にも関わっているなんておどろきですね。
この動画が面白いです。
イントロンの役割まとめ
今回の内容をまとめました。
・スプライシングのやり方を変えることで、さまざまなタンパク質を効率的につくる
・エキソンを入れ替えることで、新しいタンパク質をつくる
・飢餓状態におかれると、生存のためにタンパク質合成を抑え、エネルギーを節約する(=生存に関与する)
海外の生物学の教科書がひんぱんに更新される理由がよくわかりました。
次のエッセンシャル細胞生物学には、イントロンの新たな知見が追加されるかもしれませんね。
【参考】