Target-AIDの原理をわかりやすく解説【バイオジャパン2019セミナーを聴講して】
切らないゲノム編集Base Editing(BE、ベースエディティング、塩基編集)について、以前David Liuの技術をご紹介しました。
今回ご紹介するには、日本発の塩基編集技術Target-AIDです。
神戸大学の西田敬二先生が開発されたゲノム編集技術です。

出典:神戸大学バイオ生産工学研究室
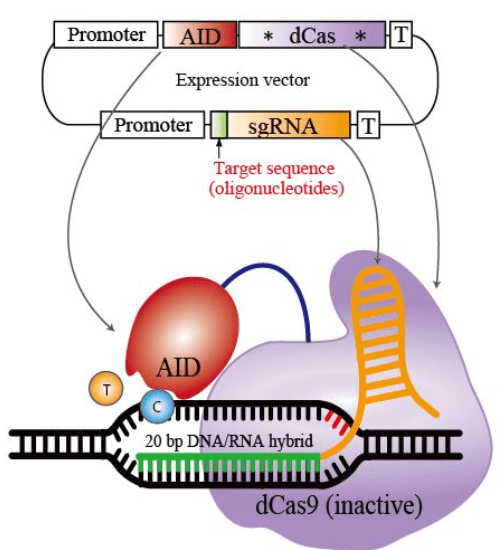
西田先生のTarget-AIDはBEと同様に、デアミナーゼという脱アミノ化酵素を利用して、塩基を脱アミノ化させて変異を導入します。
David LiuのBEと基本的な原理は同じですが、使用するデアミナーゼが異なります。
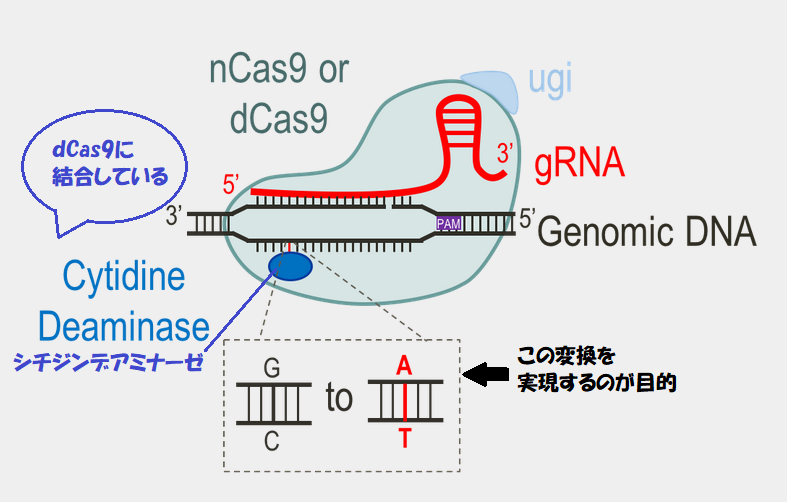
西田先生が使用したデアミナーゼは、AIDのファミリーであるPmCDA1。これと切れないハサミであるdCas9を組み合わせて使用しています。
デアミナーゼにはいろいろあり、どのデアミナーゼを使うかで、変異が導入される部位や幅に変化が生じます。
Target-AIDは日本発の塩基編集技術であること、西田先生の設立されたバイオパレットが米バイオベンチャーBeam Therapeutics社と独占ライセンス契約を今年締結していることから、今後もキャッチアップしていけるように、Target-AIDについて調べました。
今回の記事は、2019バイオジャパンで聴講した有料セミナーの情報をもとにしています。
2019バイオジャパン・CRISPRセミナー
セミナーの内容すべてを理解することはできませんでしたが、Target-AIDの全体像について説明します。
Target-AIDの原理をわかりやすく解説
Target-AIDとは簡単に言うと、
直接DNAを切断することなく、ピンポイントで、ある塩基を別の塩基に変換し、変異を起こさせる技術です。
”ピンポイント”な狙い撃ちには、おなじみのCRISPR-Cas9を使い、
”変異の導入”には、AIDという脊椎動物の持つ酵素を利用しています。
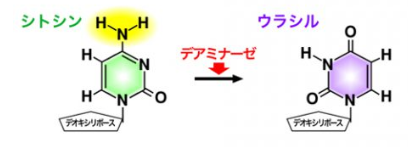
AIDとは、Activation-induced cytidine deaminase(活性化誘導シチジンデアミナーゼ)の略です。
AIDは、免疫グロブリンがいろいろな抗原を認識できるように、免疫グロブリンに高頻度に変異を導入する酵素です。
脊椎動物の獲得免疫機構でみられる、高頻度に変異を導入して抗体の多様性を作り出す現象を体細胞超変異といいますが、この現象の主役がAIDです。
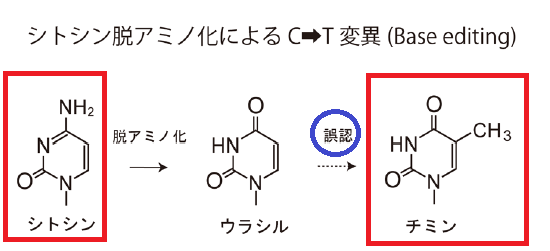
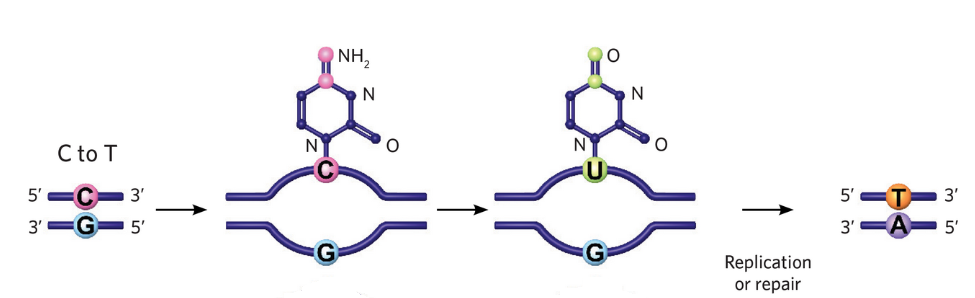
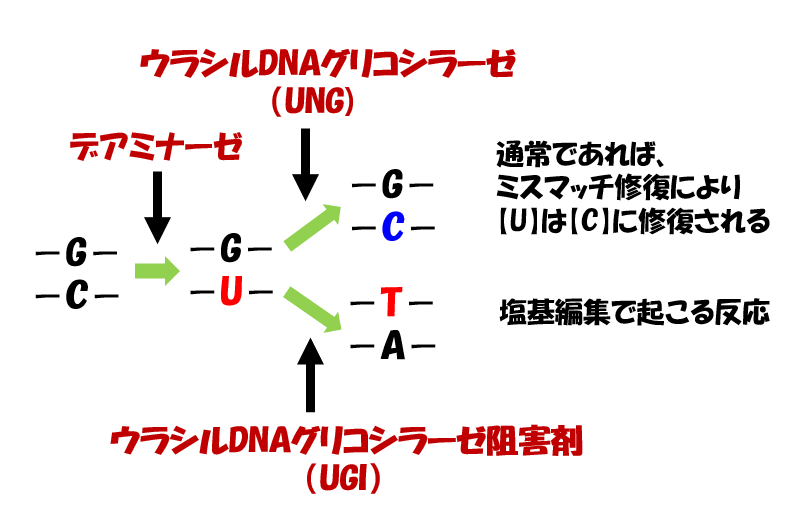
CRISPRの仕組みを利用して標的を狙い、AIDの高頻度に変異を導入する仕組みを利用して、シトシンをウラシルに変換するわけですね。
AIDの脱アミノ化によって、DNAのシトシン(C)が、RNAのみにあるウラシル(U)に変換されると、チアミン(T)と構造が似ているウラシルは、チミンと誤認され、【C→T】変異となります。
抗体が多様性を獲得するのを助けるAIDをゲノム編集に応用したのがTarget-AIDです。
しかし、AIDの積極的に変異を導入する性質からおわかりのように、AIDをそのまま使うと生体にとって危険ですよね。標的部位でないところに変異が導入される恐れがあります。
AIDによる脱アミノ化をゲノム編集に応用するには、AIDの活性を抑え、周辺部位に変異をもたらさないことがポイントとなります。
西田先生は、ヤツメウナギ由来のPmCDA1が活性が非常に高く、かつ、周辺部位に変異をほとんどもたらさないことを見出しました。
そこで、ヤツメウナギ由来のPmCDA1とdCAs9の組み合わたTarget-AIDを開発しました。
面白いことに、Target-AIDとCRISPRにはある共通点があります。
AIDとCRISPRの持つ共通点「R-loop構造」
CRISPRとAIDにはR-loopという共通点があります。
R-loopとは、DNAとRNAが形成したDNA-RNAハイブリッド2本鎖と1本鎖DNAにより構成される構造をいいます(下図)。
出典:ヒトにおいてRad52およびXPGを介したRループ構造の解消により転写共役型相同組換え修復がひき起こされる
CRISPRとAIDに着目すると、いずれもDNA二本鎖が開かれて、一本鎖DNAが露出され、R-loopが形成されています。
つまり、CRISPRもAIDも、2本のDNAが一時的にはなれ、一本鎖DNAになったときに作用しているのです。
✔CRISPR
出典:Using CRISPR Technology for Allergy and Asthma
✔AID
出典:R Loops: From Transcription Byproducts to Threats to Genome Stability
AIDが変異を導入するためには、このR-loop構造が必要と考えられています。
CRISPRとAIDに共通する分子メカニズムから、CRISPRとAIDを組み合わせることは親和性が高いと考えられました。
そこで、CRISPRでハサミとなるCas9タンパク質から切る能力を取り除き、AIDを結合させて、標的部位のみを脱アミノ化させて狙った場所に変異を導入するTarget-AIDが開発されました。
しかし、ヤツメウナギ由来のAIDを用いても、変異の導入効率はまだ十分でなく、もうひと工夫必要となりました。
Target-AID改良のポイントは「ニック」
変異効率を上げるうえでボトルネックとなるのが、生体が本来持つ修復機能です。
変異を導入しても、細胞が自己修復によって戻してしまうと、望ましい変異率を得られませんよね。
西田先生が行ったのは、変異を導入しない方のDNAにあえてニックという切れ目をいれることでした。
西田先生の論文にそのことが書かれています。
効率を高める手法として、Cas9の2つあるヌクレアーゼ活性を一つだけ残したニッカーゼを用いることができる。これはDNA二重鎖の裏鎖のみを切断し、表鎖の脱アミノ化された塩基部位の正常な修復をバイパスすることによって変異効率を上げるものである。(デアミナーゼを用いたゲノム編集)
すぐに理解できず、ほかの資料を探したところ、別の論文にもう少しかみ砕いた記載がありました。
脱アミノ化によって生じたウラシルと近傍の反対側の鎖にニックが同時に導入されたときに、ニック側の片鎖DNAが解離しやすくなり、その状態を修復すべくヌクレオチド除去修復(Nucleotide excision repair; NER)が作動する。NERはある程度の長さの塩基を除去したのちに相補鎖を鋳型として埋め戻すため,相補鎖にウラシルが存在していると,それに対合するアデニンを挿入することになり,変異として固定されることになる.(ピンポイント塩基編集による次世代育種の可能性)
わかりづらいという方のために、ニックを入れることで変異効率を上げるメカニズムについて、図とあわせて説明します。
変異を導入したい鎖とは別の鎖にニック(切れ目)をいれると、ニックが導入されたDNA鎖は解離します。
ここで、生体がもつ修復機構が作動し、ニックが導入されていない鎖のウラシル(U)を鋳型にして相補的なアデニン(A)が挿入されます。
このときのウラシル(U)は、実はデアミナーゼによってシトシン(C)が脱アミノ化されて変異したものですよね。
本当はこれが修復されるべきところ、修復機構は、塩基が存在しないもう一方の欠損部位に気を取られ、変異であるウラシル(U)を鋳型に相補的なアデニン(A)を挿入してしまうわけです。
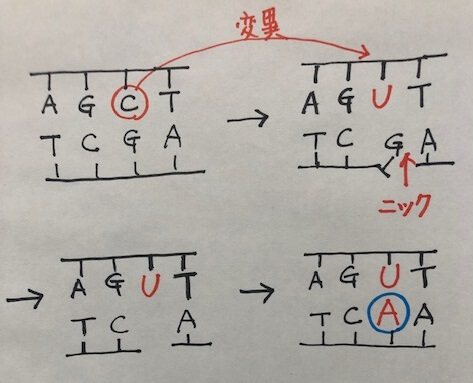
まるでおとり作戦のようですよね。ニックで気を引いて、(C)→(U)への変異が見つからないようにごまかしています。
アデニンが挿入されると、UーAの対合は一見問題なく見えるため、ウラシルは固定されます(変異は修復機構に気づかれぬまま)。
そして、複製により、U → T への変異が進みます。つまり、C → U → Tへの変異が完了しました。

このようにして、脱アミノ化により、シトシン(C) → チアミン(T)へ効率的に変換できるわけですね。
では、David LiuのBEとTarget-AIDにはどんな違いがあるのでしょうか?
David LiuのBEとTarget-AIDの違い
LiuのBEと西田先生のTarget-AIDの違いは、変異が導入される箇所(ウィンドウ)の幅と位置です。
✔BEでは、変異が標的配列のやや中央よりの広い領域に導入されます。
✔一方、Target-AIDでは、標的配列のPAM配列とは反対側の5塩基程、特にその中央のCに対して高い効率で変異をできます。
出典:デアミナーゼを用いたゲノム編集
PAM配列とは
Cas9がDNAを切断するときに必要となる目印で、特定の塩基配列のこと。標的配列の近くにある。
Target-AIDの方がより狭い範囲に変異を導入できるわけですね。
まとめ
今回は西田先生のTarget-AIDの技術をご紹介しました。
Target-AIDは日本発の、DNAを切らず、塩基を変換することで変異を導入するゲノム編集技術です。
CRISPRの課題であるオフターゲット効果を回避できる塩基編集は、今後ますます注目されていくと思います。
同日の濡木先生の講演では、疾患変異の58%は1塩基に変異が生じる点変異が原因で、35%の遺伝性疾患は塩基編集で治せるというお話がありました。
西田先生が設立されたベンチャー「バイオパレット」は、塩基編集の先駆者であるDavid Liuが設立した米バイオベンチャーBeam Therapeutics社と独占的クロスライセンス契約を締結しており、今後ますます切らないゲノム編集の研究が進んでいくと思われます。
参考:(米) Beam Therapeutics社と塩基編集技術(ゲノム編集技術)に関する独占的クロスライセンス契約を締結しました。
CRISPRを使ったゲノム編集技術の動向は、再生医療ともリンクしますので、今後も注視していきます。
✔ゲノム編集を理解したい方が最初に読むのにおすすめな本
とにかくわかりやすいです。食品の表示問題に関心のある方にはこの本がおすすめ。生物の基礎がなくても読めます。
わかりやすく、かつもう少し突っ込んで知りたい方におすすめ。ゲノム編集の過去から現在までの流れを把握するのに最適。筆者の熱意が伝わる1冊。
※アイキャッチ画像の出典:科学研究費助成事業 研究成果報告書
【参考】