【タンパク質の高次構造】サブユニットとドメインの違いは?
こんにちは、あゆみです。
今回はタンパク質の階層構造についてみていくとともに、わかりづらいサブユニットとドメインの違いを解説します。
今回の内容
タンパク質の高次構造
サブユニットとドメインの違い
前半では、タンパク質の構造、サブユニットとドメインとの違いについて説明します。
後半では、特許明細書での使われ方を見ていますが、興味のない方は飛ばしてください。
キーワード
前半:一次構造、二次構造、三次構造、四次構造、サブユニット、ドメイン
後半:亜酸化窒素、バイオセンサ、NMDA受容体
※高校・大学生物のおさらいで読まれる方は前半だけ読めばOKです。
では、さっそくみていきましょう。
タンパク質の構造
一次構造
出典:Khan Academy
一次構造とは、アミノ酸配列のことをいいます。
タンパク質はアミノ酸がペプチド結合によってつながっています。つながったものをポリペプチド鎖といいます。
タンパク質の種類ごとにアミノ酸の並び方が決まっており、この並び方をアミノ酸配列といいます。
二次構造
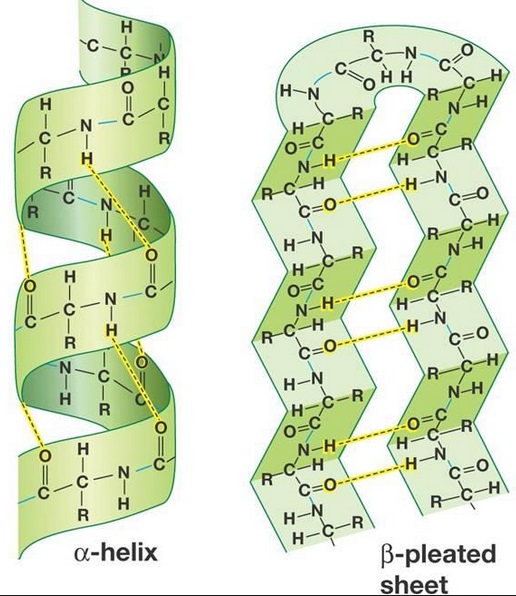
出典:Socratic.org
タンパク質は自身が最も楽で落ち着く状態、つまりエネルギーが最小になる形で折りたたまれています。
この折りたたみ方には2種類あることがわかっています。αヘリックスとβシートです。
αヘリックスは1本のポリペプチド鎖がよじれて、同じポリペプチド鎖の中でC=O基とN-H基が水素結合を形成するので、リボン状のらせん状態になります。
βシートはポリペプチド鎖が伸びた構造で、隣り合った鎖の間で水素結合を形成するため、並行した平面的な構造になります。
タンパク質がαヘリックスやβシートをつくる部分を二次構造といいます。
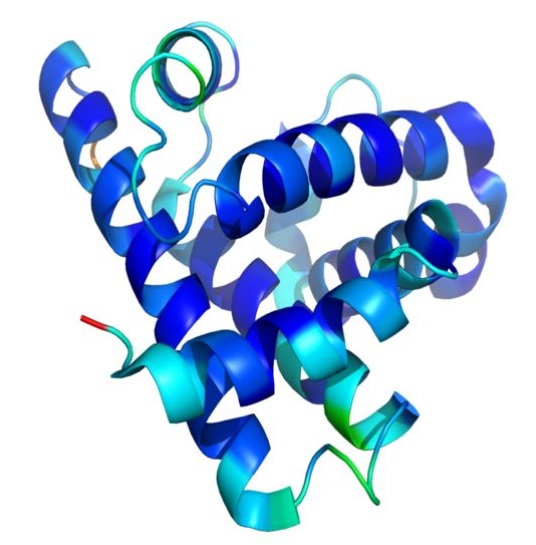
三次構造
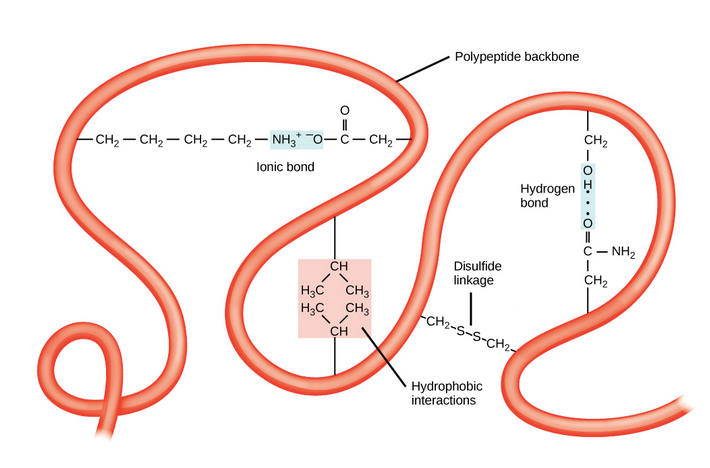
出典:Khan Academy
二次構造が折りたたまれた、1本のポリペプチド鎖が形成する立体構造を三次構造といいます。
二次構造では水素結合が全体の安定化に寄与していましたが、三次構造では水素結合のほかに、疎水性相互作用、イオン結合などの非共有結合、ジスルフィド結合も寄与します。
ここで、ドメインという概念について説明します。
三次構造は1本のポリペプチド鎖による立体構造を指しますが、三次構造のユニットをドメインといいます。ドメインは三次構造の一部の領域ですが、構造的にまとまった、独立して安定した領域のことをいいます。ドメインについては後で再度説明します。
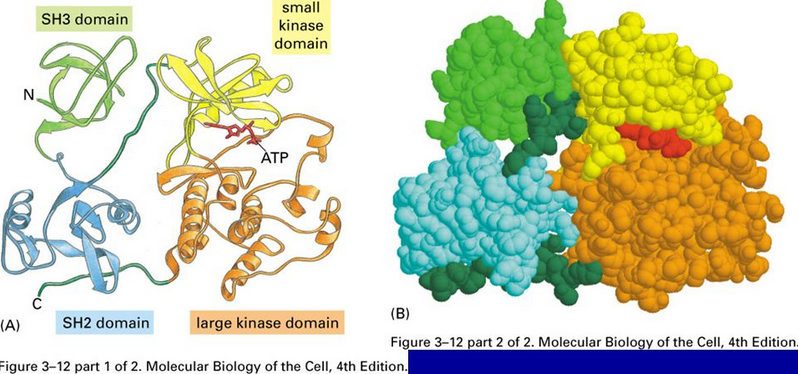
出典:東大医科研ヒトゲノム解析センター 中井謙太先生の資料より
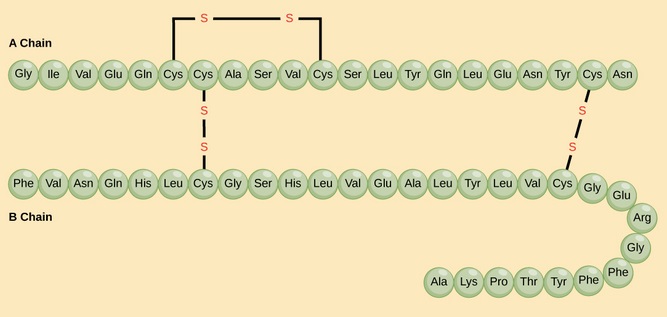
四次構造
複数のポリペプチド鎖が会合した状態を四次構造といいます。
四次構造を構成する個々のポリペプチド鎖をサブユニットといいます。
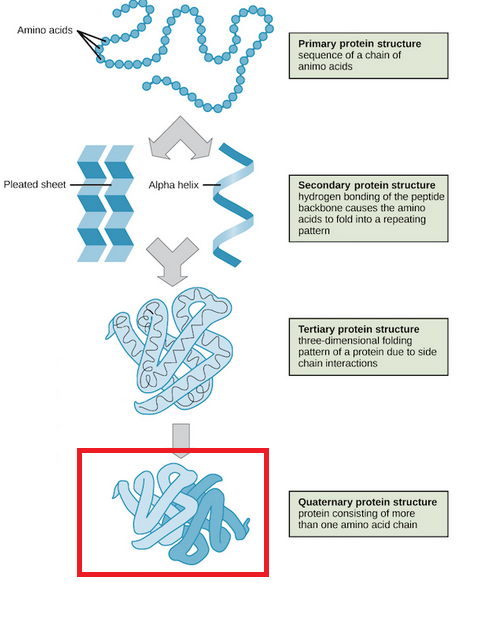
出典:Khan Academy
たとえば、ヘモグロビンはαグロビンとβグロビンというサブユニットから構成されます。。
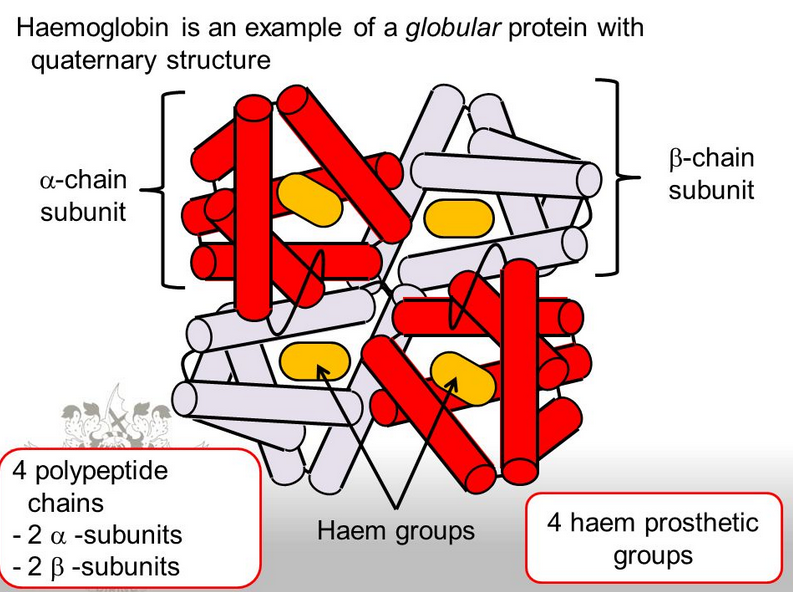
出典:slideshare
サブユニットとドメインの違い
サブユニットとドメインについて頭が混乱しそうでしたので、図解しました。
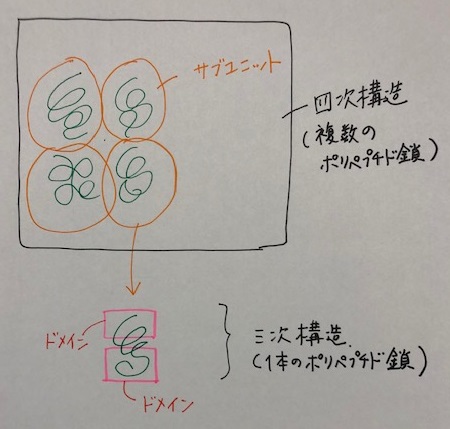
三次構造は1本のポリペプチド鎖が形成する立体構造であり、そのポリペプチド鎖の局所的な部分で、独立して機能する領域のことをドメインといいます。
四次構造は複数のポリペプチド鎖が集まったもので、個々のポリペプチド鎖をサブユニットといいます。
つまり、サブユニットには複数のドメインがあるということですね。
すると、こんな疑問がでてきそうです。
次のように考えました。
三次構造は、1本のポリペプチド鎖が形成する「構造」に着目した考え方であり、サブユニットは、四次構造の「構成要素」に着目した考え方だと思っています。
このようにイメージしたことで、この画像だって怖くないぞ!かかってこいや!となりました。
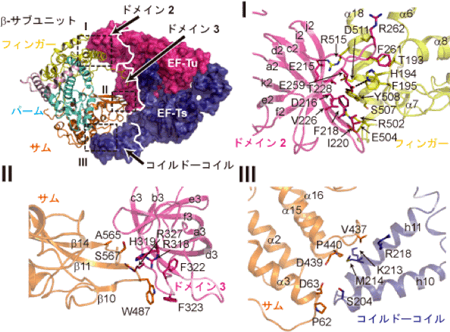
出典:産総研
さらにイメージで理解を固める
ここで学校を例に、サブユニット、ドメインについて理解を固めておきます。
1学年4クラスの学校をイメージしました。
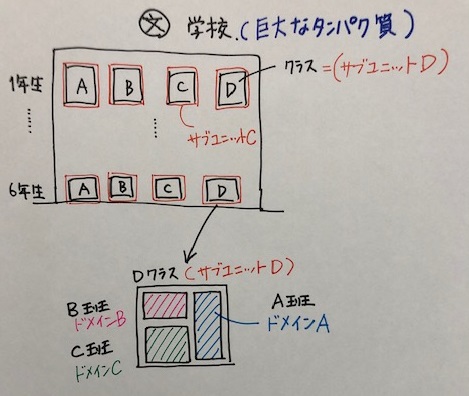
図からお分かりの通り、
学校=巨大なタンパク質
クラス=サブユニット
クラスの各班=ドメイン
クラスの中で行う班分け。規模は小さくても、グループ討論など、独立して、機能をはたしていますよね。ドメインのイメージに近いかなと思いました。
学校によって1学年のクラス数や、1クラスの生徒数が異なるように、タンパク質も大きなものもあれば、小さいものもあります。
小さなタンパク質の場合は、過疎地域にある学校のイメージです。大きなタンパク質は都心部の学校のイメージですね。
タンパク質の階層構造、ドメイン、サブユニットの概念を理解したところで、鹿島建設の特許を読んでみます。
特許明細書での使われ方を確認
鹿島建設の環境対策
亜酸化窒素(N2O)をご存知でしょうか?
亜酸化窒素は、二酸化炭素の310倍の温室効果があり、京都議定書で排出規制の対象となっています。
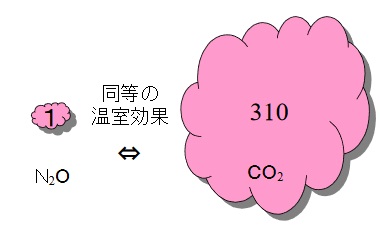
出典:国土交通省
亜酸化窒素が関係する分野は、下水道分野です。
下水汚泥の焼却と排水処理の過程で排出され、特に下水道からの排出では亜酸化窒素の比率が高いのが特徴です。
ですので、亜酸化窒素の排出を抑える取り組みは、土木業者にとって避けられない問題です。
鹿島建設の特許は、一言でいうと、亜酸化窒素を高感度で検出するバイオセンサの発明です。
亜酸化窒素による弊害
亜酸化窒素は笑気ガスとしても知られ、NMDA受容体に結合し、NMDA受容体の機能を麻痺させることが明らかになっています。
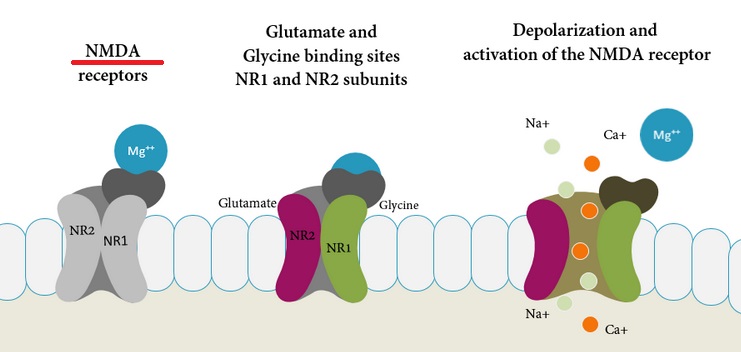
出典:Anti-N-methyl-D-aspartate (Anti-NMDA) Receptor Encephalitis – A Synopsis
NMDA受容体は、グルタミン酸受容体の一種で、記憶、学習、脳虚血などにかかわる受容体です。中枢神経系においてシナプス形成やシナプス可塑性(シナプス部位における電気的な伝達効率が長期的に変化する現象)など脳機能にかかわります。
工場などから排出される亜酸化窒素の量をモニタリングするために、これまでにクロマトグラフによる測定方法や、還元反応を利用して電気化学的に検出するセンサなどが使われてきました。
特に、電気化学的に検出する場合、酸素が存在すると、酸素に対しても同時に反応してしまうという問題がありました。
鹿島建設のバイオセンサは、NMDA受容体のタンパク質にリガンドが結合すると、タンパク質の自家蛍光が変化する仕組みを利用しています。このバイオセンサは、酸素存在下でも高感度に亜酸化窒素を検出できます。
鹿島建設の特許概要
今回読んだ特許
特開2009-63497
バイオセンシング方法、バイオセンサ及び亜酸化窒素測定キット
鹿島建設株式会社
まず自家蛍光とは、ミトコンドリアやリソソーム、コラーゲンなどが、光を吸収したときに自然に光を放出する現象をいいます。
今回の発明のすごいところがこれです↓
従来は、NMDA受容体に結合すると思われるリガンドをあらかじめ標識してから、NMDA受容体と相互作用させ、各候補物質の標識の有無にもとづいて評価していました。
今回の特許では、あらかじめ標識するプロセスを省くことができます。
どうやるのでしょうか?
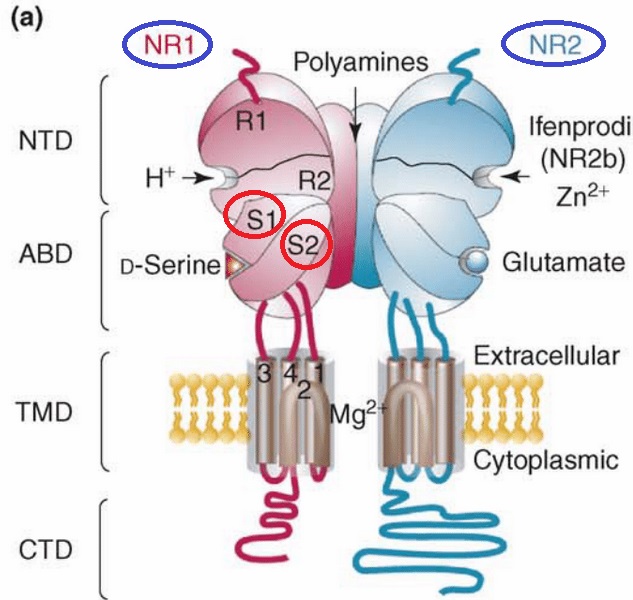
出典:Neuro-chemical analysis of cortical spreading depolarizations after severe traumatic brain injury : a continuum from a physiologic response to a metabolic crisis?
NMDA受容体はNR1とNR2の2つのサブユニットから構成されています。
NR1にはグリシン結合部位があり、NR2にはグルタミン酸結合部位があります。
さらに、NR1とNR2には、基質結合ドメインである、S1領域とS2領域があります。この領域に、グリシン、グルタミン酸、そして亜酸化窒素などが結合します。
特許では、まずコントロール(対照)の蛍光強度を確認しています。次に、リガンド候補物質(亜酸化窒素)を加え、蛍光強度が変化するかを確認しています。蛍光強度が変化したら、亜酸化窒素がサンプル液中に存在することになります。
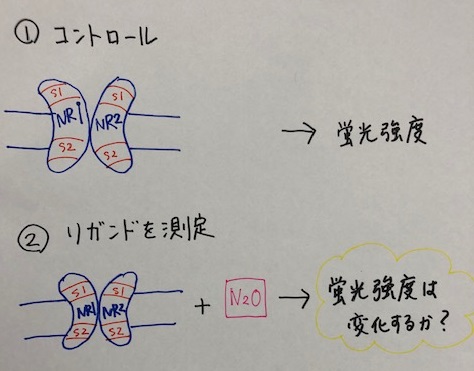
結果、亜酸化窒素濃度に依存して、最大蛍光強度に変化が認められました。
この特許の技術は、亜酸化窒素の検出だけでなく、NMDA受容体リガンドのスクリーニングにも利用できるようです。
まとめ
今回はバイオの学び直しとして、タンパク質の階層構造に注目しました。引き続き、遺伝子分野への苦手意識を払拭していきます。
お約束の3Dプリンタ製NMDA受容体です。
分子やタンパク質の3Dモデリングにも興味がわいてきました。どんなソフトがあるか調べてみます。
出典:biologicmodels.com
※アイキャッチ画像の出典:brighthub.com
【参考】
http://www.bio.tottori-u.ac.jp/~mizobata/14-Seika1-protein_structure.htm
特開2009-63497(バイオセンシング方法、バイオセンサ及び亜酸化窒素測定キット)
関連記事
サイトカインを3Dプリンタで造形してみた ー薬剤師国試でも「本質」理解を重視しようー