【再生医療】緩慢凍結法とガラス化法の原理/課題/各研究事例について

再生医療では、細胞をつくる、増やすだけでなく、細胞を保存することも大変重要になります。
細胞の機能を損なわずに保存するうえで関係してくるのが、水特有の性質です。
なぜなら、細胞の70%が水でできているからです。
今回は、再生医療と密接に関係する低温生物学の角度から、細胞の凍結保存方法である緩慢凍結法とガラス化法、それぞれの課題、研究成果の一部をご紹介します。
目次
細胞凍結保存における課題は水分子の結晶化
水が氷になると体積が増えますよね。
これには水素結合が関係しています。
液体の水分子は、水素結合によって結ばれたり、切れたりが繰り返されているため、ランダムな構造になっています。
これに対し、氷の水分子では、水素結合が規則正しく形成され、安定した構造になっています。水分子と水分子の間にすきまができるので、液体の水分子よりも体積が増える、というわけです。
出典:chemistry.stackexchange.com
水分子がもつこの特徴は、細胞を凍結保存したいときにやっかいな問題を引き起こします。
細胞の約70%は水で構成されており、培養細胞を凍結すると、細胞内と細胞外の水分が結晶化します。
この時、細胞内の水分が結晶化すると、細胞膜や細胞内小器官などを物理的に壊してしまいます。

出典:Natural zwitterionic betaine enables cells to survive ultrarapid cryopreservation
これでは解凍後の細胞は生存することができません。
つまり、細胞を凍結保存する上で、細胞内・細胞周辺部での水分の結晶化を抑えることが非常に重要であることがわかります。
そのためには、結晶化させないことがポイントになります。
ですので、
不規則な分子構造のまま凍結させる必要があります。どうするのでしょうか?
細胞の凍結方法でポイントなるガラス化
水分子をランダムな状態のまま凍らせることをガラス化といいます。
もう少し詳しく説明します。
液体の水のように、ランダムな状態で固まると、水分子は不規則なまま動かなくなります。このとき、水分子は固体ですが、氷のように規則的な配列ではありません。このような固体の状態になることを、ガラス化といいます(下図の真ん中)。
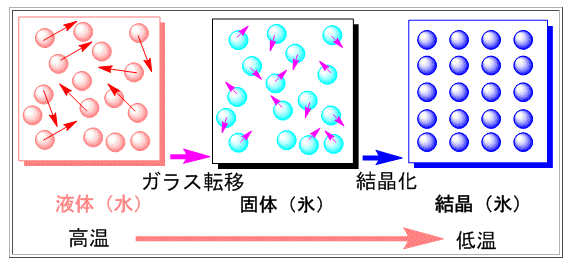
出典:http://www.kiriya-chem.co.jp/q&a/q68.html
ガラス化状態の特徴
・固体である
・不規則な構造である
ガラス化状態にすればいいのはわかりますが、
普通に凍らせたら、細胞内の水は結晶化し、体積が増えて細胞を傷つけてしまいますよね。
ランダムな状態のまま凍結させるために、これまで2つの手法が使われてきました。
・緩慢凍結法
・ガラス化法
どちらも共通点は、凍結保護剤を使用します。
両者の大きな違いは次のとおり。
凍結緩慢法=ゆっくり凍結する
ガラス化法=急速に凍結する
以下、もう少し詳しくみていきます。
緩慢凍結法の原理
緩慢凍結法は、凍結保護剤を使用して、ゆっくりした冷却速度で長時間かけて冷却して細胞を凍結することです。
わかりやすいように、図にしました。
細胞の内外にはもともと水分がありますよね(スタートの状態)。
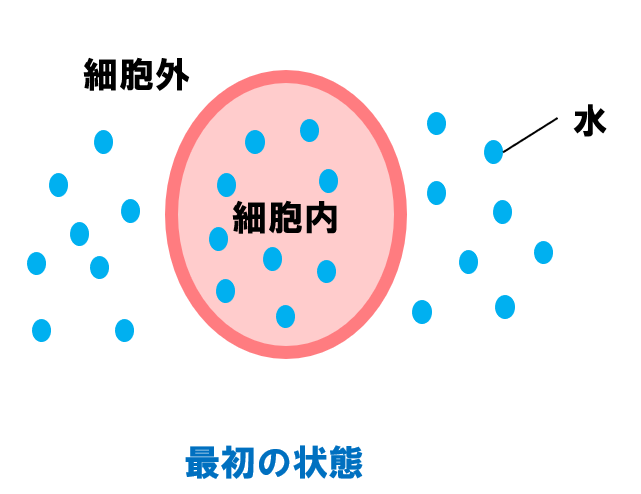
👇冷却すると、細胞の外にある水分が徐々に結晶化します。
これにより、細胞の中と外に浸透圧差が生じ、細胞内の水分が細胞外へ出ていきます。
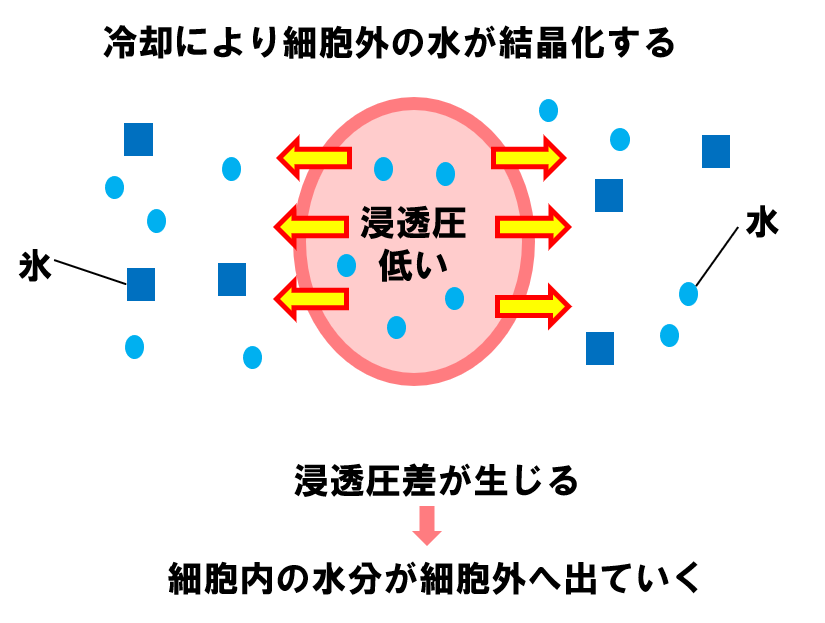
細胞の外にある水分の結晶化がさらに進むと、浸透圧差によって細胞内の水分がさらに外へ出ていきます。最終的に、細胞内が脱水し、十分に濃縮された状態になります。
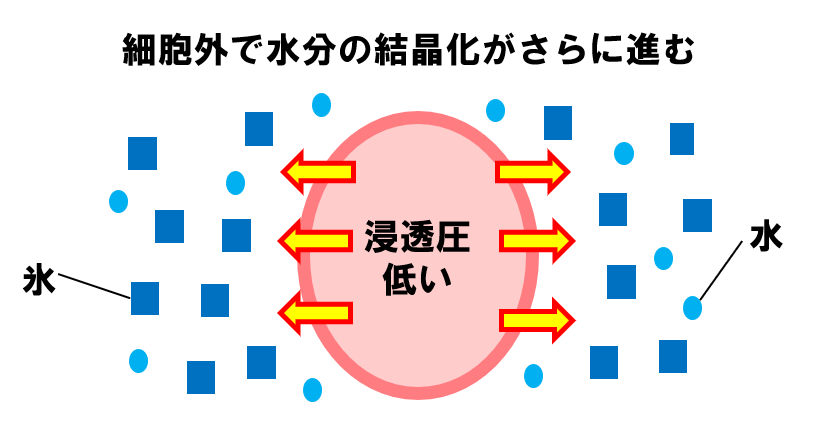
以上が緩慢凍結法の原理です。
緩慢凍結法の課題
緩慢凍結法には、次の課題があります。
・時間がかかる
・解凍後の生存率が非常に低い
この欠点を解決するために、近年は、ガラス化法が用いられています。
ガラス化法の原理
ガラス化液で処理した細胞を液体窒素に直接ひたし、急速に冷却する方法をガラス化法といいます。
※ガラス化液とは、凍結保護剤を含む溶液を指すと理解しています。
High-Throughput Non-Contact Vitrification of Cell-Laden Droplets Based on Cell Printing
ガラス化液の具体例としては、DAP213があります。DAP213は、マウス受精卵の保存用に開発されたガラス化液です。
ガラス化法は、急速に冷却させることで水分を結晶化せずにガラス化状態で凍結できるため、緩慢凍結法に比べて、短時間でできるのが利点です。
しかし、使用するガラス化液が高濃度のため、浸透圧による細胞への毒性が非常に強いという欠点があります。
そのため、ガラス化するための凍結保護剤に細胞を懸濁してから、液体窒素にひたすまでの時間を10~30秒程度にするなど、迅速な操作が求められるため、ハンドリングが容易ではありません。
ガラス化法の課題
ガラス化法の課題をまとめると次のとおりです。
浸透圧による細胞への毒性が非常に強い
ハンドリングが容易ではない
ガラス化法は、ES細胞、iPS細胞を保存するほか、こちらの記事でご紹介した細胞シートを保存する場合にも使用されています。
しかし、細胞シートを凍結保存させるときに、細胞シートがひび割れたり破れてしまうという問題がありました。
この問題を改善するために行われている研究をいくつかご紹介します。
改良されたガラス化法
明治大・東海大の凍結細胞シートの製造方法
この技術のポイントを一言でまとめると、
使用するガラス化液を最小限にしました
たとえば、次のように大量のガラス化溶液を用いて細胞を冷却させる手法が報告されています(図はイメージ)。
出典:特開2016-059290を改変
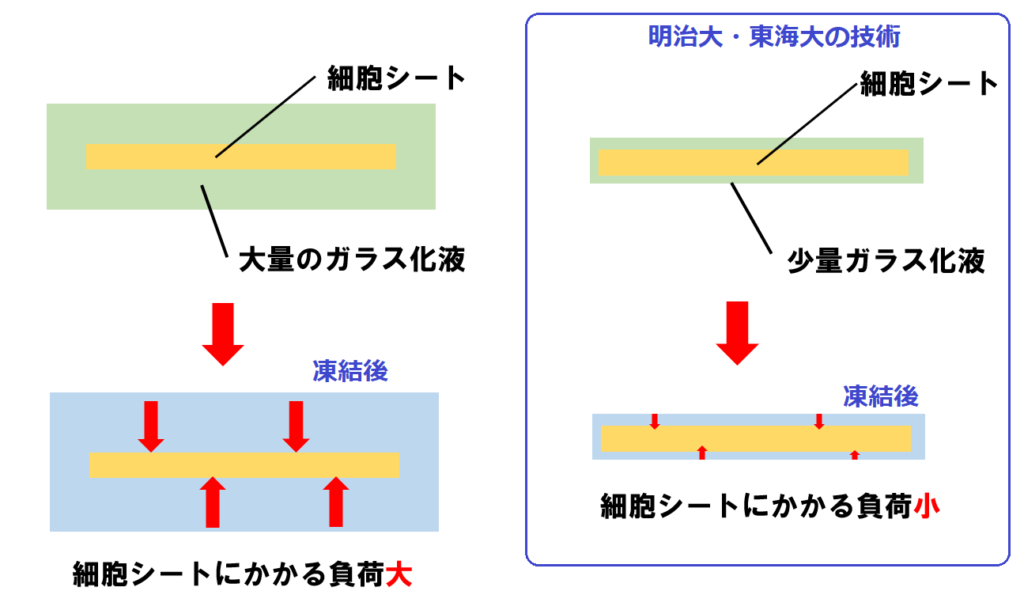
細胞シートの場合を図にしたのが次のイラストです👇。
特開2013-111017をもとに作成
図で、左側はガラス化液を大量に使う場合を示しています。
これを窒素液体に浸した場合、ガラス化液が大量に存在するため、その中にある細胞シートの冷却速度が十分ではなくなります。
また、ガラス化液と細胞シートが凍結する速度が異なるため、凍結する過程で、ガラス化液が先に凍結し、細胞シートに負荷がかかる可能性があります。これにより、細胞シートにひび割れや破れなどが生じてしまいかねません。
これに対し、右側は明治大・東海大が開発した技術を示しています。
細胞シート表面が露出しない程度に、極めて薄くガラス化液で覆っています。つまり、使用するガラス化液を最小限にしました。
こうすることで、細胞シートを急速に凍結できるほか、凍結したガラス化液が細胞シートに与える負荷も小さくなるわけですね。
京都大学の開発したDMSOフリー凍結保存液
この技術のポイントを一言でまとめると、
食品添加物として使用されるε-ポリ-L-リジンにカルボキシル基を導入しました
松村和明先生・玄准先生は、従来のガラス化法で使用されていた、DMSO、アセトアミドを使わない新規凍結保存液を開発しています。
DMSOはジメチルスルホキシドの略で、分化に影響を及ぼす可能性があり、アセトアミドは発がん性があるとされています。上述のDAP123にはDMSOとアセトアミドが含まれています。
松村先生が開発した凍結保存液は、食品添加剤としても使われるε-ポリ-L-リジン(PLL)にカルボキシル基を導入したものです。

出典:特開2015-149905
カルボキシル基の導入率が65%の場合、凍結保護効果が最も高かったようです。
このPLLを使ったガラス化液は、従来のガラス化法にあったもう1つの問題をクリアしています。
ガラス化法は前述の通り、急速に冷却して、水を結晶化せずにガラス状態にする方法ですが、溶解時に再結晶化が起こり、細胞を傷つけてしまうという問題もありました。

出典:京都大学 ヒトiPS細胞の効果的凍結保存法の確立
PLLを加えたガラス化液では、室温に戻した時に再結晶化はみられませんでした。また、この手法によれば、急速凍結は必要でなく、ゆっくりと凍結することが可能になります。
急速凍結に伴う細胞への物理的ダメージを避けられるほか、高度なハンドリングも必要ありません。
村松先生による発明(特開2015-149905)は、細胞シートと三次元培養体に適用できるものです。
さらにすごい研究成果が、2019年4月に信州大学より発表されました。
なんと、凍結保護剤を使わない方法です。
【世界初】信州大学が確立した凍結保護剤を使わない凍結保存技術
これは細胞の凍結保存に関する研究成果です。
※細胞シートの凍結保存ではありません。
出典:Cryoprotectant-free cryopreservation of mammalian cells by superflash freezing
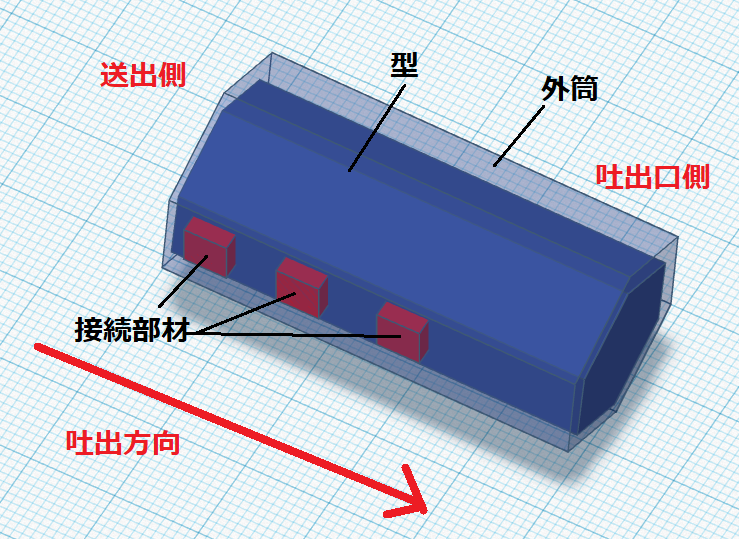
信州大学が開発した方法は、凍結保護剤を使わず、細胞を微小液滴に内包し、インクジェットでガラス基板上に吐出して、瞬間的に細胞を凍結するものです。
ガラス基板は液体窒素で冷却されており、吐出された細胞が基板に着滴すると、瞬間的に冷却されて凍結する仕組みです。
マウスの筋芽細胞、ラットの初代間葉系幹細胞に適用したところ、いずれも生存率が従来法と同等であることが確認されました。
凍結保護剤による未分化状態への影響や、細胞毒性などの問題を回避できますので、この研究成果は今後の創薬や再生医療への応用が期待されますね。
論文も発表されています➡https://www.pnas.org/content/116/16/7738
まとめ
再生医療を実用化させるうえで、培養技術だけでなく、細胞や細胞シートの機能を損なわずにいかに保存するか、も非常に重要であることがわかりますね。
こんなことをイメージしました。

冷蔵庫が壊れ、修理の予約もとれず、新しい冷蔵庫を買っても配達が3日後という状況で、市場直送のカニが大量に届いても取っておくことができない……
再生医療において、細胞の凍結保存技術というのは、これに近いものがありますよね。
例えがイマイチかもしれませんが、作る技術と保存する技術の両輪で実現してこそ、実用化への道が開かれることがわかりました。
ちなみに、細胞の低温状態に対する耐性や、細胞の凍結保存、長期保存に関する学問を低温生物学ということを初めて知りました。
j-stageで61巻2号(2015年)以前の学会誌は無料でダウンロードできます。
引き続き勉強します!
【参考】
特開2013-111017(凍結細胞シートの製造方法)
特開2015-149905(細胞シート及び三次元細胞培養体の凍結保存のための緩慢ガラス化方法)
こちらの記事もおすすめ
【心筋機能再生に挑戦】iPS細胞を用いた心筋シートが実現する医療【心臓の再生医療】
【mRNA医薬】ワクチン開発を席巻する欧米ベンチャー 日本のとるべき戦略は?